Fichier27.html
Commentaires sur l'arbre des éléments (ElemenTree) de Fernando Dufour
par Pierre Demers

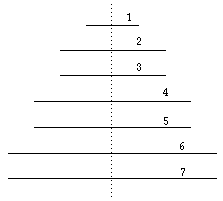
FIG. 1. Schéma de l'arbre des éléments : vue de côté, les plateaux et les périodes.
Présentation
L'arbre des éléments ou "sapin périodique" est une structure tridimensionnelle formée d'un pylône haut de 27 cm et de plateaux inégaux de contour hexagonal, le plus grand étant situé en bas et ayant près de 20 cm de diagonale.
Les alcalins et les alcalino-terreux, ainsi que l'hydrogène,, apparaissent sur le pylône, les autres éléments, période par période, sur les plateaux.
Originalité
L'originalité véritable de l'arbre des éléments est de distinguer le caractère des éléments selon la distance entre sa case, où est inscrit son symbole, et l'axe de l'arbre. Il semble que l'arbre des éléments ait été le premier à présenter une telle organisation. Ni l'auteur, ni les commentateurs précédents ne l'ont signalé.
Schématiquement, le caractère d'un élément est défini par celui de son électron caractéristique ou de valence, et celui-ci a l'un de 4 caractères, décrits par les lettres s, p, d ou f ou par la valeur de l, quantum azimutal. (C'est le caractère quantique azimutal).
Distance de l'axe = caractère de l'élément
distance 0 = caractère s, l= 0
distance 1 = caractère p, l = 1
distance 2 = caractère d, l = 2
distance 3 = caractère f, l = 3
Deux dimensions sont évidemment insuffisantes puisque l'on veut garder ensemble les éléments de chaque période. En effet, les mêmes caractères se rencontrent dans plus d'une période. Chaque période requiert les 2 dimensions d'un plateau, passer d'une période à l'autre requiert une 3e dimension.
De plus, chaque fois que des éléments d'un caractère se présentent dans une période, leur nombre est le même.
Éléments s : il y en a 2
Éléments p : il y en a 6
Éléments d : il y en a 10
Éléments f : il y en a 14
On aperçoit là la possibilité de superposer selon des colonnes verticales les cases de même caractère et de périodes différentes.
La distance 0 est celle des éléments figurant sur le pylône. Le cas de l'hélium est une dérogation à l'analyse que nous présentons ici, l'auteur de l'arbre des éléments ayant préféré le placer seul sur un plateau 1. Notre analyse est basée sur la structure de l'atome.
Distance 1 : celle des cases p formant un hexagone.
Distance 2 : celle des cases d placées dans une couronne de 12 cercles.
Distance 3 : celle des cases f placées dans une couronne de 18 cercles. FIG. 2.
On voit que les cases d et f occupent incomplètement les cases de leurs couronnes respectives.
Voici comment les éléments sont répartis sur les plateaux de l'arbre. FIG. 2 à 9.
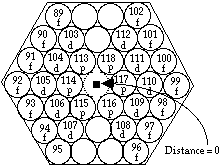
FIG. 2. Plateau et période 7. Les cases s sont sur l'axe, distance 0;
les 6 cases p forment 2 lignes brisées de 3 cases chacune;
les 10 cases d, 2 lignes brisées de 5 cases chacune;
les 14 cases f, 2 lignes brisées de 7 cases chacune.
Les éléments s (soit 87 et 88), sont inscrits à la distance 0, sur le pylône.
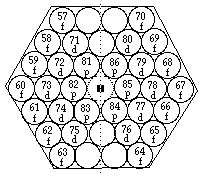
FIG. 3. Plateau et période 6. Comme plateau et période 7 sauf les valeurs de z.
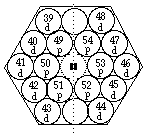
FIG. 4. Plateau et période 5. Comme plateau et période 7 sauf les valeurs de z et l'absence de cases f.
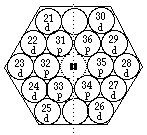
FIG. 5. Plateau et période 4. Comme plateau et période 7 sauf les valeurs de z et l'absence de cases f.
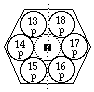
FIG. 6. Plateau et période 3. Comme plateau et période 7 sauf les valeurs de z et l'absence de cases d et f.
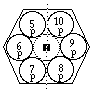
FIG. 7. Plateau et période 2. Comme plateau et période 7 sauf les valeurs de z et l'absence de cases d et f.
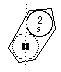
FIG. 8. Plateau et période 1. Par exception, le plateau 1 ne porte qu'une case, et une case s, celle de He qui est un élément s.
Symétries et critiques
Recherchant la symétrie dans la classification, au moins 3 critiques se présentent. Elles ajoutent aux commentaires de Scerri, Lemelin et Perreault
1. Éléments sur le pylône. Placer les éléments s ailleurs que sur les plateaux suggère qu'il existerait une discontinuïté importante entre ces éléments et les éléments p, d et f. Or cette suggestion n'a pas de justification chimique ou électronique et elle induit en erreur. Ainsi, les électrons de valence s et p du carbone sont indiscernables, concourant à donner les 4 valences égales bien connues : c'est le carbone tétraédrique.
2. Cases vides. Au total, 16 cases sont vides. On peut voir là un pas dans la bonne direction, puisque, dans le tableau traditionnel de Mendeleev, 36 cases restent vides. Mais l'idéal serait de n'avoir aucune case vide.
On souhaiterait mettre à profit une forme géométrique qui ne laisserait aucune case vide. Tant que cela n'est pas réalisé, la question (naïve, instinctive, naturelle) se pose : pourquoi y-a-t'il des cases vides?
3. Passage à 2D. Il n'y a pas de moyen immédiat de transformer la classification 3D de l'arbre des éléments en une classification 2D.
Si on place côte à côte les plateaux des périodes 1 à 7, il manque 13 éléments inscrits sur le pylône, qui restent de côté.
Telle qu'utilisée dans l'arbre des éléments, la géométrie du nombre 6, n'est idéalement ou parfaitement adaptée à la classification que dans les périodes 2 et 3 et pour les atomes p.
Une classification des éléments qui réaliserait "cette belle symétrie qui accompagne toujours la vérité" (dixit André Lemelin, 1995), voilà l'idéal restant à trouver.
Le système du québécium représente un essai dans ce sens.

FIG. 9. Dans le système du québécium, une période occupe 2 grilles carrées égales et opposées, où les éléments de même caractère dessinent des équerres des divers caractères : f, d, p et s, ces dernières étant réduites à une seule case. Les quadrants occupés sont NO et SE.
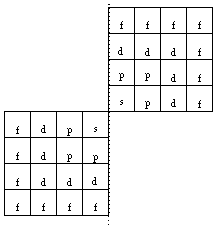
FIG. 10. Les 2 grilles de la figure précédente , disposition alternative occupant les quadrants SO et NE
Passer de l'arbre des éléments au système du québécium
Dans le système du québécium : (FIG. 9)
1. les périodes occupent 2 grilles carrées opposées et
2. les éléments des divers caractère occupent une équerre, ligne brisée à 90o. (Équerre réduite à une case unique dans le cas des éléments s).
On peut apercevoir dans l'arbre des éléments une construction intermédiaire (intermédiaire, parce qu'on imagine, comme point de départ ou de référence obligé, le tableau traditionnel de Mendeleev), conduisant aisément, par une transformation bien choisie, à l'organisation du système du québécium :
1. sur les plateaux, les périodes occupent 2 losanges complets opposés, si l'on y inclut une case vide et
2. les éléments de chaque caractère y occupent une ligne brisée à 120o.
Le passage peut se décrire géométriquement, par exemple sur la période 7. Dans une première opération, on sépare les losanges. FIG. 11.
Dans une 2e opération, on fait pivoter les losanges de 30o autour de l'axe. Dans une 3e opération, on transforme par glissement au contact les losanges en carrés. FIG. 12.
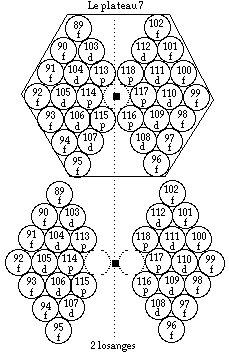
FIG. 11. Période 7. L'arbre des éléments et sa transformation.
En haut : le plateau 7. On y reconnaît 2 losanges ayant une case commune.
En bas : on a séparé les losanges.
Continuez à la figure suivante.
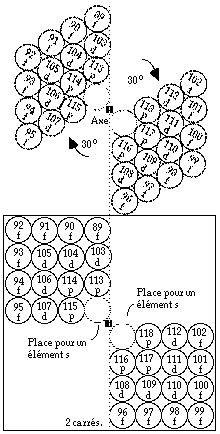
FIG. 12. Période 7. Suite. En haut : on a fait pivoter les losanges de 30o dans leur plan autour de l'axe. En bas, on a remplacé l'arrangement interne en losanges par un arrangement en carrés. En plaçant les éléments s, on retrouve une figure précédente montrant la période 7 au complet dans le système du québécium. FIG. 9.
Les 2 cases vides sont disponibles pour les 2 éléments s de la période.
Dans ce passage, la géométrie de nombre 6 est devenue celle du nombre 4.
La période 7 occupe incomplètement un carré de 8 cases de côté et les quadrants SO et NE sont vides. On peut aussi bien la loger dans les quadrants SO et NE (FIG. 10) et alors les quadrants NO et SE sont disponibles pour recevoir la période 6. Les périodes 6 et 7 ainsi réunies forment une strate.
La classification du québécium comporte 4 strates, contenant respectivement 2, 16, 36 et 64 éléments. Il n'y a que 2 cases vides sur 120, et dans les versions récentes, il n'y en a aucune.
Ces strates peuvent être disposées 3D l'une au dessus de l'autre ou placées 2D côte à côte à volonté. FIG. 13.
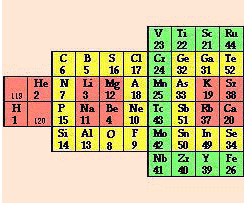

FIG. 13. Classification des éléments dans le système du québécium. Deux cases sont vides dans cette version.
Références
1. Charles Janet 1929
http://web.ccr.jussieu.fr/tarantola/Files/Professional/Mendeleev/Janet_1929.pdf
2. Paul-Émile Giguère (1965)
Tableau périodique 3D. Ouvrez le fichier QbMai2004 Giguère3D.
http://chemlab.pc.maricopa.edu/periodic/giguere.html

FIG. 14. Le Tableau en 4 tablettes de Paul-Émile Giguère, vers 1964. Un caractère (azimutal) par tablette : s, p, d, f. Les annotations sont de nous. H et He absents.
3. Glenn T. Seaborg 1969, 1989,
Chem. News
4. Francis Perrin 1973,
C. r., 1973.
Chimie physique. - Une nouvelle forme du tableau de Mendeléeff,
Présentation d'une nouvelle forme complète et compacte du tableau de Mendeléeff…
C809-812
5. Francis Perrin 1974,
Sc. et Avenir, 192, 24-26.
6. Fernando Dufour 1979,
An attemps to unravel atomic structure with a three-dimensional model of the periodic table,
Thèse de maîtrise, Université Concordia, Montréal
7. Fernando Dufour 1981, 1982,
La classification des éléments et la molécule spdf,
Spectre, revue de l'APSQ Association des professeurs de science du Québec,
11, 1, 22-28, octobre 1981*;
11, 2, 45-56, décembre 1981;
11, 3, 5-9, mars 1982.
*introduction de Gilbert Lannoy
8. Carole Thibaudeau 1982.
La molécule spdf de Fernando Dufour : outil scientifique et pédagogique.
La Presse, jeudi 27 mai
9. André Lemelin 1995,
De l'ordre dans le tableau (tableau de Fernando Dufour)
Québec-Science, 34, 3, 36, novembre
Il y a deux méthodes de classement : par la périodicité des propriétés chimiques et par la structure de l'atome.
... le tableau périodique est demeuré un monument inachevé - sans doute le seul parmi les grands édifices de la science à ne pas arborer cette belle symétrie qui accompagne toujours la vérité.
10. Eric Scerri 1997, 1998,
La classification périodique des éléments,
Pour la Science n° 253 novembre 1998
(American Scientist, nov.-déc. 1997, 546-553,
Scientific American, sept. 1998, 78-83)
11. Mathieu Perreault 2003,
La beauté du tableau périodique (Le tableau en 3 dimensions de Fernando Dufour),
La Presse, Actuel 8, dimanche 23 novembre
12.
http://agora.qc.ca/mot.nsf/Dossiers/Tableau_periodiquehttp://mendeleiev.cyberscol.qc.ca/carrefour/objets/tableauxarbredates-dufour.jpg
http://agora.qc.ca/mot.nsf/Dossiers/Fernando_Dufour
13. George B. Kauffman
http://chemeducator.org/bibs/0004003/00040308.htm
14. Bob Jacobs 2004. Un répertoire de plusieurs dizaines de références (qui cependant ne mentionne ni Janet, ni Giguère, ni Tarantola, ni Francis Perrin, ni Dufour, ni Demers). Dernière heure : accès problématique.
http://www.chemistrycoach.com/periodic_tables.htm#Periodic%20Tables%20of%20Historical%20Interest
15. J. P. Serodino
http://perso.wanadoo.fr/j.p.serodino/francais/index/ch4/Resume_ch4.htm
16. D. Rouvray et Bruce King 2004,
The periodic Table: Into the 21st Century
13 chapitres. À paraÎtre en juin. "International Conference on the Periodic Table held from July 14 to 20, 2003. Titled "The Periodic Table: Into the 21st Century,.." ISBN: 0 86380 292 3 Price: £55
Research Studies Press
http://www.research-studies-press.co.uk/ http://www.research-studies-press.co.uk/book_detail.asp?ID=101&category=FORTHCOMING%20TITLES&series=NON%2DSERIES+%2D+OTHER http://www.highbeam.com/library/doc0.asp?DOCID=1G1:113299307&refid=ip_almanac_hf
17. Maurice M. Kibler 2004
Classyfying chemical elements and particles: from the atomic to the sub-atomic world
http://arxiv.org/ftp/quant-ph/papers/0310/0310155.pdf
18. Pierre Demers , 1995...
Le système du Québécium http://www.lisulf.quebec/quebecium.html
et les liens
----------------------------------------------------------------------
Observations sur l'article d'André Lemelin
De l'ordre dans le tableau (tableau de Fernando Dufour)
Québec-Science, 34, 3, 36, novembre 1995
Cet article mérite doublement notre attention. Il est la tentative d'analyse la plus sérieuse encore parue sur l'arbre des éléments. Il est d'ailleurs le seul article que la réputée revue Québec Science, en ses 40 ans d'existence, ait jamais fait paraître sur la classification périodique des éléments. Aussi, 9 années plus tard, en l'an 2004 (et après un changement de siècle)! il serait grandement temps de faire la lumière sur plusieurs passages qui répandent des notions fausses et demanderaient correction ou éclaircissement.
1. ".. il n'est tout simplement pas possible d'intégrer correctement" les lanthanides et les actinides "dans un tableau 2D".
Ils sont pourtant fort bien intégrés dans le tableau de Francis Perrin 1973 et 1974, celui de Glenn Seaborg 1969, et déjà dans le tableau de Charles Janet 1928-1929.
2. "La plus grande innovation de mon modèle, dit Fernando Dufour, est de révéler la nature gémellaire du système périodique".
Fernando Dufour aurait-il été le premier à signaler cette nature gémellaire? Elle est pourtant très apparente dans les tableaux de Perrin, de Seaborg et de Janet.
En revanche, Fernando Dufour ne fait pas état de la véritable innovation de son modèle, mentionnée plus haut : la distance entre une case et l'axe de son arbre est proportionnelle au quantum azimutal, 0, 1, 2 ou 3.
3. "Sur les disques, la spirale fait autour de l'axe des boucles"..."à mesure que croît le nombre
atomique et la charge énergétique des éléments".
Qu'est-ce que la charge énergétique des éléments (qui augmenterait avec le nombre atomique des éléments)?
On trouve une quantité appelée charge énergétique dans une référence sur l'électromagnétisme.
Mais elle n'a rien à voir avec la classification des éléments. Serodino.
4. "... l'arbre périodique tient compte de tous les électrons de chacun des éléments", alors que, dans les meilleurs tableaux périodiques "le classement est conforme aux seuls électrons de valence".
Affirmation gratuite et incompréhensible. Dans l'arbre des éléments comme dans les meilleurs tableaux périodiques, la place de chaque élément est simplement définie par le caractère de l'électron caractéristique ou de valence.
5. "Plus on descend le long de l'axe, plus le niveau de l'énergie est élevé"...
Cette proposition ressemble à 3 ci-haut. En descendant le long de l'axe, on passe d'un atome z à un atome z+1 puis z+2 etc. Quelle serait donc la sorte d'énergie dont le niveau augmenterait avec z? Voici 3 définitions possibles de l'énergie des atomes; aucune ne s'accorde avec la proposition en cause.
Énergie totale. L'énergie totale d'un atome comprend l'énergie de toutes les particules composantes, électrons, protons et neutrons avec leurs masses au repos et leurs interactions mutuelles. Le changement d'énergie à chaque étape est de l'ordre de 2 Gev et il est surtout de nature nucléaire. Il a peu à voir avec les niveaux d'énergie électroniques et surtout ce serait une banalité d'en faire état, depuis le temps qu'est connue la relation E = mc2.
Énergie d'ionisation de l'électron caractéristique ou de valence. C'est ce qu'on appelle encore l'énergie ou le potentiel de première ionisation ppi. Or le ppi varie relativement peu et irrégulièrement avec z. Les valeurs extrêmes sont environ 24 ev pour He et 4 ev pour Cs, soit une diifférence d'un facteur 6. Le niveau de l'énergie de cet électron est plus bas quand le ppi est plus élevé. Schématiquement, le ppi est élevé pour les gaz rares et bas pour les alcalins. On ne peut pas dire qu'il augmente systématiquement avec z.
Énergie totale de liaison, égale à masse totale de l'atome moins masse totale des particules isolées. Pour simplifier, ignorons le changement de masse du noyau. Or le niveau de l'énergie d'un électron donné est négatif et, lorsque le noyau passe de la charge +z à +(z+1), il change d'un facteur voisin de (z+1)2/z2; il devient plus profond, il diminue en valeur algébrique. L'électron devient plus fortement lié. Quant à l'électron supplémentaire qui se trouve ajouté, lui aussi a un niveau négatif puisqu'il est lié et il accroît ainsi le bilan négatif. Ce bilan est voisin sinon identique de la dépense d'énergie nécessaire pour enlever tous les électrons et ne conserver que le noyau de l'atome. C'est l'énergie d'ionisation totale de l'atome. À mesure que z augmente, le niveau d'énergie de cette sorte n'augmente pas, il diminue.
L'idée que "le niveau de l'énergie augmente avec z" semble provenir d'une confusion rhétorique entre la théorie des atomes (z variable) et la théorie des états excités de l'atome d'hydrogène (excitation électronique variable, z = 1 = constante). Ces états excités présentent une succession de niveaux d'énergies croissantes.
6. "Si l'on fait face à l'axe s, on remarque que tous les symboles des éléments placés sur la gauche sont entourés d'un cercle (ou d'un carré) épais, montrant leur électronégativité (ils gagnent un électron), tandis que ceux qui se trouvent à droite sont entourés d'un cercle fin, indiquant leur électropositivité (la perte d'un électron). C'est la symétrie horizontale de l'arbre".
L'axe s est vertical et confondu avec l'axe de l'arbre. La demande de l'auteur, de faire face à l'axe s, n'a pas de solution unique. Peut-être voulait-il dire : regardez la figure en face.
Plutôt que dire gagner ou perdre un électron, mieux vaudrait dire tendre à gagner un électron et c'est l'électronégativité, ou à perdre un électron et c'est l'électropositivité. Un atome au repos ne gagne ni ne perd un électron.
Il serait correct de dire que les éléments de gauche sur la figure ont un spin d'un signe et ceux de droite, un spin de l'autre signe. Il s'agit du spin de l'électron caractéristique ou de valence. Il ne faudrait pas confondre électropositivité et électronégativité d'une part et signe du spin d'autre part.
7. La figure du modèle de M. Dufour est imprimée à l'envers, ce qui n'aide pas à la compréhension. Cette typographie défectueuse dessert l'auteur et Fernando Dufour tout autant et confond le lecteur, qui se demande s'il faudrait lire la figure en l'inversant droite gauche.
8. On parvient à reconnaître sur la figure que Fe, Co, Ni, Cu et Zn sont entourés d'un cercle épais, ce qui montrerait leur électronégativité, ce qui est faux puisqu'ils sont électropositifs. De même, He, Ne, Kr sont entourés d'un carré épais, ce qui montrerait également leur électronégativité, ce qui est faux puisque ce sont des gaz rares ni électronégatifs ni électropositifs.
9. "Jusqu'à maintenant le tableau périodique est demeuré un monument inachevé...".
L'auteur voudrait-il dire qu'avec l'arbre périodique des éléments, le monument serait désormais achevé?
--AccueilDCQbMai2004.html