|
|
 |
 |
 |
|
|
|
 |
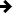 |
BIOLOGIE :
et Craig Venter créa la vie ?
|
|
Un génome créé de toutes pièces en
laboratoire donne vie à une première cellule « synthétique ». Il s'agit
du premier transfert d'un génome artificiel dans une bactérie dont l'ADN
a été retiré. Expérience réussie : la bactérie ainsi manipulée se
multiplie. Explications.
|
 |
Gare à l'emballement médiatique ! « Je ne suis pas du tout d'accord avec ce que les télévisions du monde entier ont annoncé ces jours derniers. » Joël de Rosnay*, l'ancien directeur des applications de la recherche à l'Institut Pasteur, ne mâche pas ses mots. « Craig Venter, l'auteur de la fameuse publication dans Science, n'a pas créé la vie, il a fait un copier coller du génome d'une bactérie qui existe dans la nature ». Malgré la dénégation, l'admiration pointe cependant lorsqu'il reconnaît : « Mais c'est la première fois qu'un être vivant n'a pas d'ancêtre, qu'il a pour père un ordinateur ». Avant
d'expliquer la découverte, il convient de s'arrêter un instant sur
Craig Venter dont les travaux et les déclarations font régulièrement
sensation dans le landernau mondialisé de la génétique moléculaire.
Biologiste et homme d'affaires, financé principalement par des fonds
privés, Craig Venter, en compétition avec la recherche publique, a
publié en 2000, en même temps qu'une équipe de chercheurs d'un
consortium public international, le premier séquençage du génome humain…
un génome qui s'est avéré un peu plus tard être celui de Craig Venter
lui-même. Il a depuis fondé un institut qui porte son nom The Craig Venter Institute et s'est spécialisé dans une discipline à laquelle l'ASM, l'American Society for Microbiology, vient tout juste de donner un nom : la « génomique synthétique ». * Auteur de « Et l'homme créa la vie
– La folle aventure des architectes et des bricoleurs du vivant » avec
la collaboration de Fabrice Papillon (éd. Les liens qui libèrent). Un génome artificiel de bactérie L'équipe de Craig Venter a réussi à fabriquer de toutes pièces le génome d'une bactérie connue sous le nom de Mycoplasma mycoides.
Un organisme unicellulaire très simple, composé d'un unique chromosome
dont le génome compte quelques centaines de gènes et plus d'un million
de paires de bases. Rappelons que la nature ne connaît que 4
constituants possibles pour ces bases : l'adénine (A), la thymine (T),
la cytosine (C) et la guanine (G), des molécules que l'on sait fabriquer
très facilement. Quatre ingrédients que Joël de Rosnay compare aux
quatre couleurs des cartouches d'imprimante. « Le code génétique de cette bactérie est connu, tout le monde peut se le procurer sur Internet (cf. GenBank). Le
travail des chercheurs a consisté à programmer un ordinateur capable de
lire le code génétique de la bactérie, une très longue séquence de
texte constituée des lettres ATCG, et de lancer la fabrication de ce
génome via un synthétiseur, comme on lancerait une impression depuis un
ordinateur ». Résultat : la machine a créé artificiellement
toutes les séquences du génome de la bactérie qui, une fois assemblées
dans le bon ordre, ont donné naissance à un génome synthétique
presqu'identique à son modèle naturel. Une prouesse technologique que
salue Nara Figueroa-Bossi, spécialiste de génétique bactérienne au
Centre de génétique moléculaire du CNRS : « Sincèrement, je suis admirative car du point de vue technique, ce qu'ils ont réalisé est très difficile. »
 |
 |
 |
 |
 |
 |
 |
|
 |
 |
 |
 |
|
En bleu, les colonies de Mycoplasma mycoides ayant reçu le génome artificiel
|
|
|
Un organisme 100% génétiquement modifié Mais
l'exploit ne s'arrête pas là. Les chercheurs, une équipe de vingt
personnes qui travaillent ensemble depuis dix ans, ont ensuite transféré
ce génome synthétique dans une autre bactérie, Mycoplasma capricolum,
préalablement vidée de son propre ADN. Et cet organisme unicellulaire, «
piloté » par ce génome artificiel, a pris vie, s'est reproduit, donnant
naissance à une colonie de Mycoplasma mycoides quasiment identique à sa congénère naturelle. Un
travail soigné et signé, car pour distinguer le génome artificiel de
son modèle naturel, les chercheurs se sont amusés à glisser dans le
génome synthétique des séquences de lettres qui nomment les auteurs de
l'étude ou donnent l'adresse de leur site web… à la manière des
informaticiens qui signent leurs programmes de lignes de codes maison. Une prouesse technologique « Avant
eux, personne n'avait su synthétiser et assembler une séquence aussi
longue d'ADN, ni donner vie par cette technique à ce qui peut être
considéré d'une certaine manière comme une espèce nouvelle »,
souligne Nara Figueroa-Bossi. Reste que cet exercice porte d'une part
sur un micro-organisme extrêmement simple et surtout, que les chercheurs
ne sont pas partis de rien : un être vivant - la bactérie qui a reçu le
génome synthétique - a joué un rôle crucial dans la recette. Craig
Venter n'est donc pas le démiurge annoncé par certains médias. Mais son
entreprise nous rapproche d'un temps où l'homme pourrait le devenir... Nara Figueroa-Bossi n'hésite pas à faire un parallèle avec certains aspects de la conquête spatiale. « En
envoyant des hommes sur la Lune en 1969, les Américains signaient avant
tout une prouesse technologique sans savoir vraiment à quoi cela allait
servir. Cette démarche est typique de la recherche américaine et on la
retrouve dans les travaux de Craig Venter. D'un point de vue technique,
ce qu'il a réalisé avec son équipe est remarquable. On ne sait pas
encore ce que cela va apporter mais il est certain que cette recherche
repousse un peu plus loin les frontières, ouvrant de nouvelles
perspectives. Craig Venter mentionne des applications dans les domaines
de la médecine, de l'énergie, de l'environnement… des domaines dans
lequel la génétique moléculaire est déjà très active ». Applications industrielles en vue ? En
matière de génie génétique sur les micro-organismes, presque tout est
déjà possible. Des bactéries génétiquement modifiées sont déjà utilisées
dans la production d'antibiotiques ou de vaccins. De nombreux
laboratoires manipulent quotidiennement le génome de ces
micro-organismes pour accroître leurs rendements ou leurs performances. «
A titre d'exemple, explique Joël de Rosnay, l'Institut de
Craig Venter est financé par Exxon et Dow Chimical à hauteur de 600
millions de dollars pour fabriquer du bioéthanol pour les voitures et de
l'hydrogène pour les piles à combustible à partir d'algues
photosynthétiques obtenues par biologie de synthèse. Quant à Bill Gates,
il finance un projet destiné à lutter contre le paludisme. » La
plateforme technique utilisée par Craig Venter a un prix qui la
rend hors de portée de toutes les bourses. Selon la revue Science, 32 millions d'euros auraient été investis par le Craig Venter Institute depuis une dizaine d'années. Pour autant, la manipulation génétique sur les bactéries est devenue très accessible. Selon une enquête du Monde 2
, des « biohackers » auraient installé de petits laboratoires dans leur
appartement, leur garage, leur abri de jardin, et manipuleraient
clandestinement des colonies de bactéries, hors de tout contrôle. En
repoussant une nouvelle fois les frontières, les travaux de Craig
Venter et de son équipe posent la question plus large du « bricolage du
vivant », des enjeux éthiques, sanitaires et sécuritaires que ces
manipulations génétiques soulèvent. Des sujets qui pourraient nécessiter
l'instauration d'une nouvelle réglementation. Pour Joël de Rosnay, « une mobilisation politique, industrielle et citoyenne est absolument nécessaire pour édicter de nouvelles règles. » |
 |
|

