HetJa.htm
Systme du Qubcium.
Gomtrie et nombre magique 30. dification
d'un tableau symtrique 2D des lments, de l'Hydrogne 1 au Jantium 120.
par Pierre Demers
1er dcembre 2014.
Version du 22XII2014
Traduction interdite.
Effet Pauli, spin-,
spin+. Effet Zeeman 1,
3, 5, 7.
. .
.
Dans le tableau, l'ordre est ainsi: valeurs spin - de l'lectron d'abord, puis spin +, ce qui tablit une moiti Est et une moiti Ouest. C'est l'effet Pauli. Ensuite l'effet Zeeman, gnrateur d'querres qui s'embotent
Le Tableau priodique des lments
bidimensionnel. Introduction.
Voici du CEGEP de Drummondville une introduction, avec rserves, l'atome de Bohr.
"Structure lectronique 41. Les valeurs des niveaux dÕnergie calcules par Bohr correspondent parfaitement celles du spectre dÕmission de lÕhydrogne. Cependant, le modle de Bohr prsente de srieuses lacunes. Par exemple, quand on tente de lÕappliquer dÕautres atomes que lÕhydrogne, rien ne va plus. Le modle de Bohr ne fonctionne que pour les espces chimiques contenant un seul lectron! Aprs diverses tentatives infructueuses pour tenterde lÕamliorer, on a d admettre quÕil nÕy avait rien faire: le modle de Bohr tait fondamentalement erron."
Rf.1.
www.cdrummond.qc.ca/cegep/scnature/chimie/NotesDeCours/ChimieNYA/chapitre2.pdf
Des auteurs ont dit que les atomes prsentent une nigme discute plus loin. Voici d'abord une introduction, o je reprends et mets jour une argumentation parue en 2004. Rf. 2.
Voici un diagramme de l'atome H form d'un proton et d'un lectron.
Fig. 2. L'atome d'hydrogne. Voil 7 de ses tats ou niveaux d'nergie,
entirement dfinis par le seul nombre quantique principal n. Pour n = 8, le
niveau est -0,21 ev. Pour n quelconque, en ev, il est -13,6/n2.Les transitions
entre 2 de ces niveaux sont l'origine des rayonnements qu'il met. Les
niveaux individuels ont des correspondances avec l'organisation des 120 atomes
du tableau des lments. Le niveau le plus bas est -13,6 ev, le
potentiel d'ionisation est 13,6 v. Il s'agit des nergies dues aux seules
forces lectromagntiques entre le noyau et un lectron. Au niveau 0 et plus
haut, il y a ionisation avec apparition d'un proton et d'un lectron libres. Rf.
3. Germain Salvato-Vallverdu
Ë retenir de cette figure: le niveau 1 est la source de 2 lments du tableau, soit l'hydrogne lui-mme 1 H et l'hlium 2 He. Les autres niveaux, de 2 8, sont la source des 118 autres lments, de 3 Li 120 Ja.
Thorie des atomes. Un atome est form d'un noyau de charge positive valant un nombre entier z fois l'unit, et de z lectrons. La thorie des atomes est calque sur l'atome de Bohr modifi, qui concerne l'atome d'hydrogne, lequel est de nos jours bien compris. On lui associe les noms de Abraham, Balmer, Bloch, Dirac, Heisenberg, Pauli, Rutherford, Weyl et autres et l'quation de Schroedinger, qui s'applique admirablement au systme form d'un noyau positif associ par la force lectromagntique un lectron ngatif. En revanche, cette dernire quation ne s'applique pas aux autres atomes, plurilectroniques, avec z suprieur 1. C'est alors un autre problme dit de trois corps, mieux vaudrait dire plus de 2 corps, car ce problme est connu en mcanique cleste, o il se prte des mthodes de calcul satisfaisantes par approximations successives. Dans ces approximations, on ramne le problme celui de 2 corps en considrant l'un des corps d'une part et la totalit des autres corps en prsence, d'autre part.
Les 4 variables de la thorie des quanta
Spin, n, 1, m
spin qui vaut -1/2 ou + 1/2, en abrg -
ou +
n nombre quantique principal vaut un
entier positif, 1, 2 ....
l
nombre quantique azimutal vaut un entier positif plus petit que n.
Synonymie: 0, s, R; 1, p, J; d,2, V; f, 3,
B; g, 4, Violet,
m nombre quantique magntique, vaut un
entier entre -l et l, 0 admis.
Tout atome, neutre ou ionis, rpond une description par des nombres quantiques. Un atome plurilectronique priv, par ionisation, de tous ses lectrons sauf 1, est appel un hydrognode, et rpond correctement la thorie de Schroedinger avec un noyau de charge z au lieu de l'unit. Si ce qu'on appelle l'atome de Bohr s'appliquait tous les lments, leurs potentiels de 1re ionisation seraient tous gaux 13,6 ev, comme pour l'hydrogne. Or l'exprience donne des rsultats diffrents. Fig. 3.
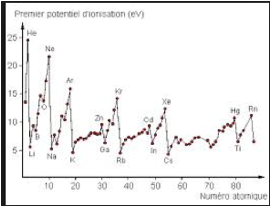
Fig. 3. Potentiels de 1re ionisation de quelques atomes. http://dc594.4shared.com/doc/gIusb5YS_26isRedirect_3Dtrue/preview.html
Il n'existe pas de thorie exacte des atomes autres que l'hydrogne. Ë partir de 2 He, dans un atome z > 2, il existe un potentiel de 2e ionisation.
dification des atomes
plurilectroniques.
J'imagine ajouter un proton et un lectron la fois au noyau de l'hydrogne, avec un certain nombre de neutrons, totalisant z protons et z lectrons. J'imagine que chaque paire proton-lectron vient de l'un des tats d'un atome d'hydrogne qui est utilis en conservant les valeurs n et l qui lui appartiennent, ces niveaux pouvant tre utiiss plus d'une fois.
On a trouv que les apports successifs se font partir d'une liste dfinie qui est celle des niveaux ou tats n = 1 8 de l'atome 1H, augmente et modifie par deux effets. Ë cette liste, je lui donne l'appellation H source. Je me rpte: pour les fins de cette dification, le niveau dplac est dfini par deux nombres quantiques: n et l, qui se conservent dans le rsultat de l'atome une fois difi.
Effet Pauli, le spin de l'lectron, qui peut tre - ou +. Il double le nombre d'tats autrement disponibles, - est le plus bas par convention.
Effet Zeeman. Cet effet ajoute le nombre quantique magntique m. Ce nombre magntique multiplie par 1, 3, 5 ou 7 le nombre d'tats disponibles, selon qu'il s'agit d'un tat s, p, d ou f, respectivement. Dans le langage couleurs du systme du Qubcium. RJVB correspond aux nombres quantiques l = 1, 2, 3, 4 ou spdf. Les valeurs - de m d'abord. Fig. 1.
Pour un atome z, je distingue son caractre et sa formule.
Pour le 120 Ja jantium, le nmro atomique est 120, le caractre est.
Caractre du 120 Ja est
8s0
Sa formule comprend en outre 119 termes crits gauche de son caractre. La voici, je la suppose crite sur une seule ligne, replie cause de sa longueur.
(NB1: spin, n, l, m)
(NB2: | sparateur)
Formule du 120 Ja est
-1s0 1s0 -2s0 +2s0 | -2p-1 -2p0 -2p1 +2p-1 +2p0 +2p1 -3s0 +3s0 | -3p-1 -3p0 -3p1 +3p-1 +3p1 -3p-1 0 -
etc. Voyez Tableau 3 dans Rf. 1.
Formule du 120 Jantium
La formule du janetium 120 ci-dessus contient celle de chacun des autres atomes qui le prcdent, de 1 H 119 By. La formule d'un atome z contient son caractre propre augment des caractres de tous les atomes prcdents depuis l'hydrogne: c'est sa formule.
Par exemple la formule du 5 Bore, dans l'ordre. S'il n'y a pas le signe -, le signe + est sous-entendu.
-1s0 1s0 -2s0 2s0 -2p-1
Le caractre du 5 Bore est le dernier terme droite.
-2p-1
qui dtermine la case de son placement dans le tableau des lments. Les lectrons libres sont tous semblables, mais dans un atome, il n'y a pas 2 lectrons ayant les 4 mmes valeurs spin, n, l, m. On doit parler d'une entit globale noyau et lectrons, o on peut discerner des paires noyau - lectron, ayant un caractre dfini. La collection de ces paires est la formule de l'atome. En criture symbolique, voici la formule nominale de l'atome z, avec une suggestion de la source
Formule nominale de l'atome z = Somme (de 1 z) (niveaux H X Pauli X Zeeman)
Il faut ajouter la formule relle, dont on sait qu'elle diffre de la formule nominale dans 19 atomes dits irrguliers. Pour ces atomes irrguliers.
Formule relle de l'atome z = Somme (1 zt avec lacunes, voir Tableau 2 Fig. 6) niveaux H X Pauli X Zeeman
Pour les 101 autres atomes.
Formule relle = Formule nominale
Correspondances.
Voici le tableau des 120 atomes avec leurs caractres. Tableaux 1, 2
Pour un atome d'hydrogne, voici la liste des triplets de valeurs de n et l permises, avec le nombre de valeurs de m permises par l'effet Zeeman, selon la rgle m = un entier entre -l et l, 0 admis.
1, 0, 1
total nombre de valeurs 1
2, 0, 1
2, 1, 3
total nombre de valeurs 4
3, 0, 1
3, 1, 3
3, 2, 5
total nombre de valeurs 9
4, 0, 1
4, 1, 3
4, 2, 5
4, 3, 7
total nombre de valeurs 16
Grand total jusqu'ici: 30.
Puis...
5, 0, 1
5, 1, 3
5, 2, 5
5, 3, 7
5, 4, 9
total nombre de valeurs 25
Pour chacune de ces paires, voici les valeurs de m permises crites sous la forme de triplets et le nombre de ces triplets
1, 0: 0, 1 valeur de m
2, 0: 0, 1 valeur de m
2, 1: -1, 0, 1
2, 1: -1, 0, 1
Tableau 1.
Systme du Qubcium.
Formule du 120 Ja Jantium. 120
termes
Niveaux de H, n, l, partir du plus bas, -13,6 ev.
Spin - d'abord, avec toutes valeurs m Zeeman. Puis spin + avec toutes valeurs
de m Zeeman.
L'ordre des atomes est impos par
l'exprience. On peut morceler la liste tel que dans la colonne de gauche, o ils sont groups en 4 strates de 2
priodes chacune, selon le plan dcrit plus bas. Ë droite, le morcellement en 7
priodes selon le tableau traditionnel de Mendeleev.
La colonne centrale
numre les tats de l'atome H
qu'on peut associer l'
lment. La somme des
entres .................................Atome H source
..............................Selon les 7 priodes
est la formule nominale
du 120 Jantium
suite des niveaux
correspondant aux tats d'atomes H
modifis par effet Pauli et effet Zeeman.........................tats en ev croissant vers le
bas.
z
nominal..Nom.......Caractre nominal...................n quantum principal, l
quantum azimutal
.........................................spin,
n, l, m.
Un lment renferme
l'entre sur sa propre ligne,
augmente des entres sur
les lignes prcdentes
depuis z = 1.
Numro z Priode Mendeleev.
Strate 1. Priode
1
1 H
Hydrogne
-1s0 1
0 -13,6 1
2
He Hlium +ls0 1
0 -13,6 1
Priode
2
3 Li Lithium
-2s0 2 0 -3,4 2
4 Be
Bryllium +2s0 2
0 -3,4 2
Strate 2.
5 B Bore
-2p-l 2
1 -3,4 2
6 C
Carbone
-2p0 2
1 -3,4 2
7 N Azote
-2pl 2
1 -3,4 2
8 O Oxygne
+2p-l 2
1 -3,4 2
9 F Fluor +2p0 2
1 -3,4 2
10 Ne Non
+2pl 2
1 -3,4 2
Priode
3
11 Na Sodium -3s0 3
0 -1,51 3
12 Mg Magnsium +3s0 3
0 -1,51 3
13 Al Aluminium
-3p-l 3
1 -1,51 3
14 Si Silicium
-3p0 3
1 -1,51 3
15 P Phosphore -3pl 3
1 -1,51 3
16 S Soufre
+3p-l 3
1 -1,51 3
17 Cl Chlore
+3p0 3
1 -1,51 3
18 A Argon
+3pl 3
1 -1,51 3
Priode
4.
19 K Potassium
-4s0 4
0 -0,85 4
20 Ca Calcium +4s0 4
0 -0,85 4
Strate 3.
21 Se Scandium
-3d-2 3 2 -1,51 4
22 Ti Titane
-3d-l 3 2 -1,51 4
23 V Vanadium
-3d0 3 2 -1,51 4
24 Cr* Chrome -3dl 3 2 -1,51 4
25 Mn Manganse -3d2 3 2 -1,51 4
26 Fe Fer
+3d-2 3 2 -1,51 4
27 Co Cobalt
+3d-l 3 2 -1,51 4
28 Ni Nickel
+3d0 3 2 -1,51 4
29 Cu* Cuivre
+3dl 3 2 -1,51 4
30 Zn Zinc
+3d2 3 2 -1,51 4
31 Ga Gallium
-4p-l 3
2 -1,51 4
32 Ge Germanium
-4p0 3
2 -1,51 4
33 As Arsenic -4pl 3
2 -1,51 4
34 Se Slnium
+4p-l 3
2 -1,51 4
35 Br Brome
+4p0 3
2 -1,51 4
36 Kr Krypton
+4p1 3
2 -1,51 4
Priode
5.
37 Rb Rubidium -5s0 5
0 -0,54 5
38 Sr
Strontium
+5s0 5
0 -0,54 5
39 Y
Yttrium -4d-2 4
2 -0,85 5
40 Zr
Zirconium -4d-l 4
2 -0,85 5
41 Nb* Niobium -4d0 4
2 -0,85 5
42 Mo* Molybdne -4dl 4
2 -0,85 5
43 Te
Techntium -4d2 4
2 -0,85 5
44 Ru* Ruthnium +4d-2 4
2 -0,85 5
45 Rh* Rhodium +4d-l 4
2 -0,85 5
46 Pd
* Palladium
+4d0 4
2 -0,85 5
47 Ag
* Argent
+4dl 4
2 -0,85 5
48 Cd
Cadmium +4d2 4
2 -0,85 5
49 In
Indium
-5p-l 5
1 -0,54 5
50 Sn
tain -5p0 5
1 -0,54 5
51 Sb
Antimoine -5pl 5
1 -0,54 5
52 Te
Tellure +5p-l 5
1 -0,54 5
53 I
Iode
+5p0 5
1 -0,54 5
54 Xe
Xnon +5pl 5
1 -0,54 5
Priode
6.
55 Cs
Csium -6s0 6
0 -0,38 6
56 Ba
Baryum +6s0 6
0 -0,38 6
Strate 4.
57 La* Lanthane -4f-3 4 3 -0,85 6
58 Ce
* Crium
-4f-2 4 3 -0,85 6
59 Pr
Prasodyme
-4f-l 4 3 -0,85 6
60 Nd
Nodyme -4f0 4 3 -0,85 6
61 Pm
Promthum -4fl 4 3 -0,85 6
62 Sm
Samarium -4f2 4 3 -0,85 6
63 Eu
Europium -4f3 4 3 -0,85 6
64 Gd* Gadolinium +4f-3 4 3 -0,85 6
65 Tb
Terbium +4f-2 4 3 -0,85 6
66 Dy
Dysprosium +4f-l 4 3 -0,85 6
67 Ho
Holmium +4f0 4 3 -0,85 6
68 Er
Erbium
+4fl 4 3 -0,85 6
69 Tm
Thulium +4f2 4 3 -0,85 6
70 Yb
Ytterbium +4f3 4 3 -0,85 6
71 Lu Lutcium -5d-2 5
2 -0,54 6
72 Hf
Hafnium -5d-l 5 2 -0,54 6
73 Ta
Tantale -5d0 5
2 -0,54 6
74 W
Tungstne -5dl 5
2 -0,54 6
75 Re
Rhnium -5d2 5
2 -0,54 6
76 Os
Osmium +5d-2 5
2 -0,54 6
77 Ir
Iridium
+5d-l 5
2 -0,54 6
78 Pt* Platine +5d0 5
2 -0,54 6
79 Au* Or +5dl 5 2 -0,54 6
80 Hg
Mercure +5d2 5
2 -0,54 6
81 TI
Thallium -6p-l 6
1 -0,37 6
82 Pb
Plomb -6p0 6
1 -0,37 6
83 Bi
Bismuth
-6pl 6
1 -0,37 6
84 Po
Polonium +6p-l 6
1 -0,37 6
85 At
Astatine +6p0 6
1 -0,37 6
86 Rn
Radon +6pl 6
1 -0,37 6
Priode
7.
87 Fr
Francium
-7s0 7
0 -0,28 7
88 Ra
Radium +7s0 7
0 -0,28 7
89 Ac* Actinium -5f-3 5 3 -0,54 7
90 Th* Thorium -5f-2 5 3 -0,54 7
91 Pa* Protoactinium-5f-l 5 3 -0,54 7
92 U* Uranium -5f0 5 3 -0,54 7
93 Np* Neptunium -5f 5 3 -0,54 7
94 Pu
Plutonium -5f2 5 3 -0,54 7
95 Am
Amricium -5f3 5 3 -0,54 7
96 Cm* Curium +5f-3 5 3 -0,54 7
97 Bk
Berklium +5f-2 5 3 -0,54 7
98 Cf
Californium
+5f-l 5 3 -0,54 7
99 Es
Einsteinium
+5f0 5 3 -0,54 7
100 Fm
Fermium +5fl 5 3 -0,54 7
101 Md
Mendlvium+5f2 5 3 -0,54 7
102 No
Noblium +5f3 5 3 -0,54 7
103 Lr
Lawrencium
-6d-2 6
2 -0,37 7p
104 Rf
Rutherfordium-6d-l 6 2 -0,37 7
105 Ha
Hahnium -6d0 6 2 -0,37 7
106 Sg
Seaborgium -6dl 6
2 -0,37 7
107 Bh
Bohrium -6d2 6
2 -0,37 7
108 Hs
Hassium +6d-2 6
2 -0,37 7
109 Mt
Meitnerium +6d-l 6
2 -0,37 7
110 Ds
Darmstadtium+6d0 6
2 -0,37 7
111 Uuu**
Unununium +6dl 6
2 -0,37 7
112 Uub**
Copernicium +6d2 6
2 -0,37 7
113 Lt
Lortium
-7p-1 6
1 -0,28 7
114 Uuq**
Flrovium -7p0 6
1 -0,28 7
115 Gi
Gigurium -7p1 6
1 -0,28 7
116 Uuh**
Livermorium +7p-l 6
1 -0,28 7
117 Du
Dufourium +7p0 6
0 -0,28 7
118 Qb
Qubcium +7pl 6
0 -0,28 7
(Priode
8, inexistante
dans
le tableau de Mendeleev.
119 By
Barthlmyum-8s0 6 0 -0,21 (8
120 Ja
Janetium
+8s0 6 0 -0,21 (8
** Appellation temporaire de l'UIPPA.
Synonymie.
120 Ubn, 119 Uue, 118
Uuo, 117 Uus, 115 Uup, 113 Uut.
* signifie lment irrgulier.
Tableau 2
Les 19
lments irrguliers*.
zt lectron terminal rel.
On donne z, zt et les lacunes et la formule depuis le gaz rare prcdent.
Le symbole en fin de ligne
est celui qui a, ou aurait s'il tait rgulier, ce numro atomique, exemples
30Zn, 45Rh.
Cr* 24,25,
(non 20) 18A 19 21 22 23 24 25Mn
Cu* 29,30,
(non 20) 18A 19 21 22 23 24 25 26 27 28 29 30Zn
Nb* 41,42,
(non 38) 36 Kr 37 39 40 41 42Mo
Mo* 42,43, (non
38) 36 Kr 37 39 40 41 42 43Tc
Ru* 44,45,
(non 38) 36Kr 37 39 40 41 42 43 44 45Rh
Rh* 45,46,
(non 38).. 36Kr 37 39 40 41
42 43 44 45 46Pd
Pd* 46,48,
(non 37,38) ).. 36Kr 39 40 41
42 43 44 45 46 47 48Cd
Ag* 47,48,
(non 38) ).. 36Kr 37 39 40 41 42 43 44 45 46 47
48Cd
La* 57,71, (non
57 70).. 54Xe 55 56
71Lu
Ce* 58,71, (non
58 70) ).. 54Xe 55 56 57
71Lu
Gd* 64,71,
(non 64 70).. 54Xe 55 56 57 58 59 60 61 62 63 71Lu
Pt* 78,79,
(non 56).. 54Xe 55 57 58 59 60 61 62 63 64 65 66 67
68 69 70 71 72 73 74 75 76 77 78 79Au
Au* 79,80,
(non 56).. 54Xe 55 57 58 59
60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80Hg
Ac*
89,103, (non 89 102).. 86Rn 87
88 103Lr
Th* 90,104,
(non 89 103).. 86Rn 87 88 104Rf
Pa* 91,103, (non
91 102) 86Rn 87 88 89 90
103Lr
U* 92,103, (non 92 102).. 86Rn 87 88 89 90 91 103Lr
Np* 93,103,
(non 93 102).. 86Rn 87 88
89 90 91 92 103Lr
Cm* 96 103,
(non 96 102) .. 86Rn 87 88 89 90
91 92 93 94 95 103Lr
Formule du 120 Janetium. Un plan
d'organisation.
Disposant donc de la liste des atomes z = 1 120, je cre un plan pour organiser davantage leur prsentation, dans l'ordre. Ce sera un tableau, de la catgorie des graphismes bidimensionnels.
Rgle 1. Je me donne un carrelage indfini de carrs vides.
Ce graphisme, je le place dans les cases d'un carrelage indfini, dont je tire un carrelage distinct pour chaque strate faire apparatre. (Anticipant sur ce qui suit: il s'agit de remplir successivement des carrelages carrs ayant comme ct 2, 4, 6 et 8 cases, et je me donne des rgles pour occuper les cases.) Voici le plus grand carrelage, lequel contient tous les autres. Il a 8 cases de ct. Je lui associe une rose des vents.Fig. 6.
Ouest - spin + Est
N
. .
.
S
Fig. 6. Carrelage carr ayant 8 cases de ct. Ouest O gauche, Est E droite. QbS2Fig297.3.gif
Rgle 2. Affectation des cases. Par moitis, Ouest spin -, Est spin +.
Rgle 3. Case de dbut de strate. La 1re case occupe sera dans le quadrant NO, au plus prs du centre de figure. Ainsi se trouve dsign un carr, centr sur l'origine.
Je chemine partir du niveau le plus profond de H, -13,6 ev, n=1, l=0, doubl cause de Pauli, spin - d'abord. Puis spin + et c'est He n = 2.
Rgle 4. Case suivante. Les cases que je choisis d'occuper sont au plus prs du centre de figure en regard cd, en symtrie par rapport au centre du carrelage, en diagonale NO, SE. Voici un placement ralis. Il reste dans le carr 2 cases vides. Fig. 6
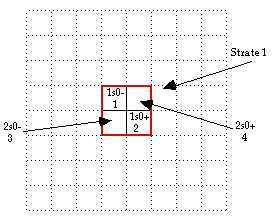
Fig. 6. Placement de H et de He. QbS2Fig298
Rgle 5. Le carr dsign doit tre rempli avant d'aborder un nouveau carr.
La suite: placement de Li et Be, les cases sont toutes occupes. Fig. 7.
.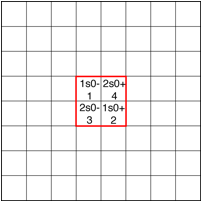
Fig. 7. Placement de Li et de Be. Strate 1.png
Et la strate 1 est complte. Il me faut passer raliser la strate 2. Dans ce qui suit, je me dispenserai de rcrire le canevas de carrs, son rle est suffisamment suggr par l'arrangement en querres que voici.
Rgle 6. Crer des querres Zeeman. Une 1re strate tant remplie, je cre une nouvelle strate, soit ici, une strate 2, que j'amorce dans le quadrant NO, avec les lments B, C et N qui sont tous -2p, formant un groupe Zeeman. Je choisis de former chacun des groupes Zeeman en une querre.
Je dis que tous les lments font partie d'un groupe Zeeman, mme les lments s ayant m = 0 que je considre comme des querres sans bras. Les autres lments font partie d'querres ayant des bras de 1, 2 ou 3 cases, et pointent obligatoirement selon une diagonale de la rose des vents.
Voici une collection des querres, chacune sous la forme de cubes pour la manipulation, aux nombres de 1, 3, 5 ou 7 cubes. Cette collection contient tous les lments de z = 1 120. Pour une prsentation graphique, je recours des cases carres. Figs 8, 9.
NDLR. Dans les figures 8 et 9, les graphismes de droite sont des mises jour des photos de gauche.
.  .
.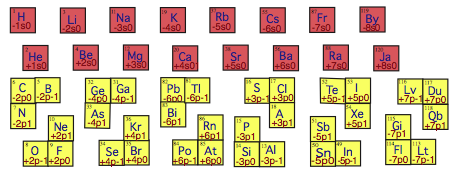 .
.
Fig. 8. Les 16 querres s sans bras. Je les nomme par le seul lment qu'elles contiennent: 1 H, 2 He, 3 Li, 4 Be, 11 Na, 12 Mg, 19 K, 20 Ca, 37 Rb, 38 Sr, 55 Cs, 56 Ba, 87 Fr, 88 Ra, 119 By, 120 Ja.
Les 12 querres ayant ayant 2 bras d'une case. Je les nomme par le 1er des lments qu'elles contiennent, dans l'ordre: 5 B, 8 O, 13 Al, 16 S, 31 Ga, 34 Se, 49 In, 52 Te, 81 Tl, 84 Po, 113 Uut ou Lt, 116 Lv, Parmi ces querres, 3 sont orientes NO, 3 orientes SE, 3 orientes SO et 3 orientes NE.
image017.pct, HHeLtFl.ai
.  .
.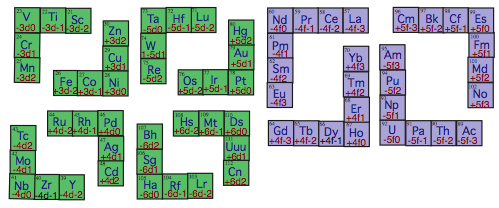 .
.
Fig. 9. Les 8 querres d ayant 2 bras de 2 cases. Je les dsigne par le 1er des lments qu'elles contiennent: 21 Sc, 26 Fe, 39 Y, 44 Ru, 71 Lu, 76 Os, 103 Lr, 108 Hs.
Parmi ces querres, 2 sont orientes NO, 2 orientes SE, 2 orientes NE et 2 orientes SE.
Les 4 querres f ayant 2 bras de 3 cases. Je les dsigne par le 1er des lments qu'elles contiennent: 57 La, 64 Gd, 89 Ac, 96 Cm
Parmi ces querres, une est oriente NO, une oriente NE, une oriente SO et une oriente SE,
image019.png, VTiThAc.ai,
Rgle 7. Sens de rotation. Il me faut choisir un sens de rotation dans les querres ayant des bras non nuls. Je cre la 1re querre ainsi rencontre BCN dans le sens de rotation anti-horloge. Cela est dterminant pour la cration des autres querres prsentes Figs 8, 9 et l'occupation des cases des carrs des strates 2, 3 et 4
Sens de rotation. Rotation anti-horloge dans les quadrants NO e SE, rotation horloge dans les quadrants SO et NE. La rgle s'nonce ainsi:
Rotations dans les quadrants: NO et SE: rotation anti-horloge; SO et NE: rotation horloge. Les flches incurves Fig. 10.
.. 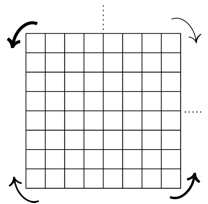
Fig. 10. L'criture est anti-horloge aux quadrants NO et SE, horloge aux quadrants SO et NE. flches.png
L'ordre du remplissage des quadrants est selon l'paisseur des traits des flches.
Muni de ces querres, je m'affaire meubler les strates 1, 2, 3, 4. Ici je remarque que la 1re querre B, C, N rencontre, place au plus prs du centre de figure dans le quadrant NO, dsigne un carr ayant 4 cases de ct. Je place immdiatement en regard la 2e querre 8 O. Fig. 11.
Voici les tapes du remplissage de la strate 1 par les 4 querres sans bras. Fig. 11.
. ![]() .Source H utilise,
valeurs n et l: 1 0, 2 0.
.Source H utilise,
valeurs n et l: 1 0, 2 0.
Fig. 11. En 4 tapes, le remplissage de la strate 1 en 4 tapes par les 4 querres sans bras de 1 H 4 Be. Lesstrates1et221h157XII2014, 2.Publication
Voici les 8 tapes du remplissage de la strate 2 par 8 querres. Fig. 12.
. . Source H utilise, valeurs n et l:
2 1, 3 0; 3 1, 4 0.
. Source H utilise, valeurs n et l:
2 1, 3 0; 3 1, 4 0.
Fig. 12. En 8 tapes, le remplissage de la strate 2 en 8 tapes par 8 querres de 5 B 20 Ca. Les strates1et221h157XII2014.
Voici les tapes du remplissage de la strate 3 par 12 querres. Fig. 13.
.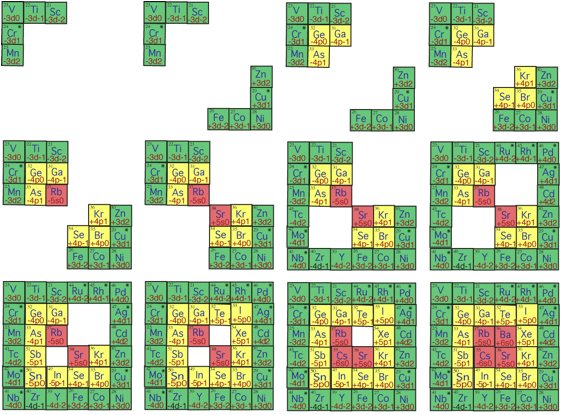 .
Source H utilise, valeurs n et l: 3 2, 4 1, 5 0; 4 2, 5 1, 6 0.
.
Source H utilise, valeurs n et l: 3 2, 4 1, 5 0; 4 2, 5 1, 6 0.
Fig. 13. Les 12 tapes du remplissage de la 3e strate, de 21 Sc 56 Sr, par 12 querres s, p et d. ScàBa9hyclesirréguliers5010XII2014, 2.Publication
. 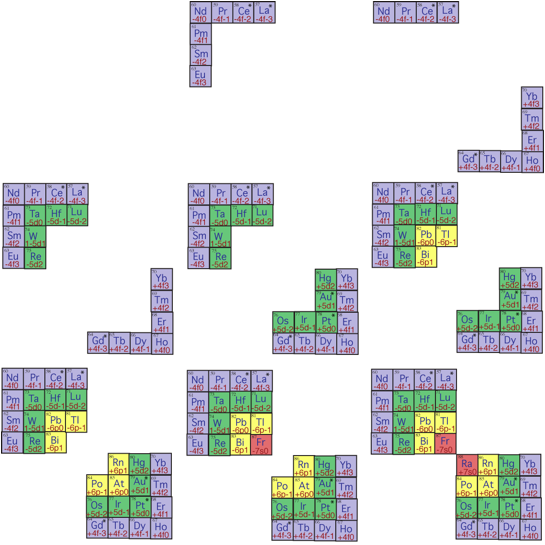 .
.
Fig. 14. Strate 4. Les 8 premires tapes sur 16 du remplissage de la strate 4, de 57 La 88 Ra, par les querres s, p, d et f. LaàRaycirréguliers18h4710XII2014.png, 2.Publication
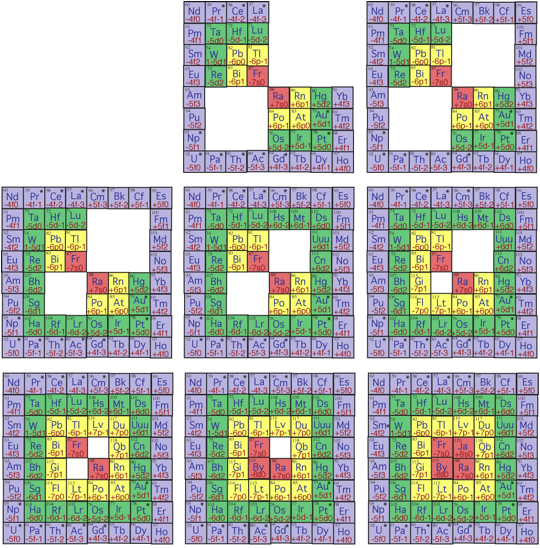 . Source H utilise, valeurs n et l: 4
3, 5 2, 6 1, 7 0; 5 3, 6 2, 7 1, 8 0.
. Source H utilise, valeurs n et l: 4
3, 5 2, 6 1, 7 0; 5 3, 6 2, 7 1, 8 0.
Fig. 15. Strate 4. Suite et fin du remplissage de la strate 4, les 8 dernires tapes. 89 Ac 120 Ja. AcàJaycirréguliers18h2010XII2014.png, 2.Publication
Et voici la totalit ses remplissages accomplis, sous la forme d'un tableau des lments en demi-ellipse. Fig. 16.
. 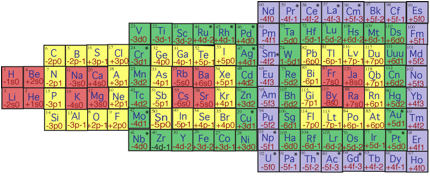 .
.
Fig. 16. D'aprs ci-dessus, tableau des lments en demi-ellipse. H à Ja y compris irréguliers11XII2014.png, 2.Publication
Ainsi se trouve obtenu, par 7 rgles gomtriques, le tableau en demi - ellipse, qui manifeste une symtrie 4 et rpond au nombre magique 30.
Une nigme du tableau priodique.
Quelle nigme?
L'nigme du tableau priodique selon Scerri, appuyant ou reprenant des considrations semblables mises par d'autres auteurs.
Voici ce que je trouve dans une publication d'Eric Scerri. Rf. 2.
(Trad. et souligns de rdaction)) "Les rgles gouvernant lÕattribution des nombres quantiques furent rigoureusement expliques par la thorie quantique, de sorte que les 2 1res couches contiennent au maximum 2 et 8 lectrons – et on eut ainsi enfin une explication des longueurs des 2 1res priodes du tableau !
Des considrations semblables appliques aux couches 3 et 4 annoncent 18
et 32 lectrons respectivement, mais cela ne sÕaccorde pas avec la
rpartition des lments dans le tableau priodique. Et cÕest l tout un
problme : la 3e priode contient 8 lectrons au lieu de 18."
Je commence par la couche 3. Si je comprends bien cet auteur, il se rfre un tableau dont la 3e priode contient 8 lments alors qu'elle devrait en contenir 18.
Couche
3.
Pourquoi le 3e priode devrait-elle contenir 18 lments? Cette hypothse peut se comprendre si on se rfre un tableau de Mendeleev traditionnel, par exemple celui du CNRS illustr Fig. 17 et si on extrapole partir du contenu des priodes 1 et 2, qui se terminent sur un gaz rare: 2 He puis 10 Ne, voyez la colonne Mendeleev du Tableau 1. Un alcalin commence la priode 2.
Ces priodes 1 et 2 renferment toutes les possibilits offertes par Zeeman pour n = 1 et n = 2 respectivement, soit 2 et 2+6 = 8 lments. Pour n = 3 ces possibilits sont 2+8+10 = 18, alors que ce qui est ralis, c'est 2+8 = 10 seulement. En extrapolant sur cette base, les lments Sc Zn, drivant de H n = 3, devraient intervenir, avec des numros z de 19 28, suivis de K qui serait 29 K et de Ca qui serait 30 Ca. Or l'ordre est invers, 29 K et 30 Ca se prsentent avant la suite 31 Sc 40 Zn.
 ..
..
Fig. 17. Un tableau de Mendeleev du
CNRS. au
format pdf![]() .
.
Ceci est, dans son dbut, la ligne 3 de Fig. 17.
![]()
11Na 12Mg 13Sc
14Ti 15V 16Cr 17Mn 18Fe 19Co 20Ni 21Cu 22Zn 23Al 24Si 25P 26S 27Cl 28Ar
Fig. 18. La ligne 3
de Fig. 17 remanie, le 3e terme tant tir se la ligne suivante 4.
Ds lors, la ligne 4 commencerait avec 29K, au lieu de 19, puis 30Ca au lieu de 20....
Couche
4.
Je pourrais faire une prsentation analogue pour la priode suivante qui serait la 4e.
Une solution l'nigme?
Il me semble que le fondement de l'extrapolation de Scerri est bref quoique rel: les priodes 1 et 2 du tableau de Mendeleev. Tant qu'on rcrira ce tableau de la mme faon, ce fondement continuera de se prsenter, on aura beau dire qu'un tableau n'est qu'un tableau. Il perptue l'inquitude d'une nigme.
En revanche, le processus d'dification du tableau par gomtrie que je propose ici-mme ne fait pas apparatre de discontinut particulire au voisinage du scandium.
Je suggre qu'une solution de l'nigme dcrite se trouve dans l'adoption du tableau par gomtrie que je propose. Il n'est pas exclu qu'il existerait des solutions quivalentes.
Remerciements.
Je remercie Patrick Callet et Maurice Kibler, qui ont prsent Montral rcemment des communictions concernant le Systme du Qubcium. Leurs observations m'ont dtermin rdiger le prsent texte. Rfs 3, 4.
Ë suivre...
22XII2014
Rfrences.
Rf. 1. Voyez le texte paru en 2004 dans le disque CD accompagnant le livre papier Pierre Demers 2004, Systme du Qubcium, La nouvelle classification des lments, PUM 2004. ISBN 2-9802454-7-X. Il est prsent en libre accs sur la toile: H et Qb : un parallle entre les tats. Fichier 23bis http://www.er.uqam.canobel/c3410/Fichier23bis.html
![]()
Voir aussi le texte papier de ce livre
papier, accessible en libre accs sur la toile.
H et Qb : un parallle entre les tats par Pierre Demers
Le prsent texte en est une mise jour en 2014. En voici un extrait, modifi afin que le dernier terme soit 8s0+ Jantium 120, et non 7p1+ Qubcum
Tableau 3. Formule du jantium.
Numros lectroniques 1 120
Numros
|
1 10 |
1s0- |
1s0+ |
2s0- |
2s0+ |
2p-1- |
2p0- |
2p1- |
2p-1+ |
2p0+ |
2p1+ |
|
11 20 |
3s0- |
3s0+ |
3p-1- |
3p0- |
3p1- |
3p-1+ |
3p0+ |
3p1+ |
4s0- |
4s0+ |
|
21 30 |
3d-2- |
3d-1- |
3d0- |
3d1- |
3d2- |
3d-2+ |
3d-1+ |
3d0+ |
3d1+ |
3d2+ |
|
31 40 |
4p-1- |
4p0- |
4p1- |
4p-1+ |
4p0+ |
4p1+ |
5s0- |
5s0+ |
4d-2- |
4d-1- |
|
41 50 |
4d0- |
4d1- |
4d2- |
4d-2+ |
4d-1+ |
4d0+ |
4d1+ |
4d2+ |
5p-1- |
5p0- |
|
51 60 |
5p1- |
5p-1+ |
5p0+ |
5p1+ |
6s0- |
6s0+ |
4f-3- |
4f-2- |
4f-1- |
4f0- |
|
61 70 |
4f1- |
4f2- |
4f3- |
4f-3+ |
4f-2+ |
4f-1+ |
4f0+ |
4f1+ |
4f2+ |
4f3+ |
|
71 80 |
5d-2- |
5d-1- |
5d0- |
5d1- |
5d2- |
5d-2+ |
5d-1+ |
5d0+ |
5d1+ |
5d2+ |
|
81 90 |
6p-1- |
6p0- |
6p1- |
6p-1+ |
6p0+ |
6p1+ |
7s0- |
7s0+ |
5f-3- |
5f-2- |
|
91 100 |
5f-1- |
5f0- |
5f1- |
5f2- |
5f3- |
5f-3+ |
5f-2+ |
5f-1+ |
5f0+ |
5f1+ |
|
101 110 |
5f2+ |
5f3+ |
6d-2- |
6d-1- |
6d0- |
6d1- |
6d2- |
6d-2+ |
6d-1+ |
6d0+ |
|
111 120 |
6d1+ |
6d2+ |
7p-1- |
7p0- |
7p1- |
7p-1+ |
7p0+ |
7p1+ |
8s0- |
8s0+ |
Rf. 2. ric Scerri 2007,
(LÕhritage Mendlvien : le systme priodique) MendeleevÕs Legacy: The
Periodic System, ©2007 , No 1, http://www.chemheritage.org/pubs//ch-v25n1-articles/feature_mendeleev_print.html
(Cette adresse m'est reste
inaccessible en 2014.)
A. "Les rgles gouvernant lÕattribution des
nombres quantiques furent rigoureusement expliques par la thorie quantique,
de sorte que les 2 1res couches contiennent au maximum 2 et 8 lectrons –
et on eut ainsi enfin une explication des longueurs des 2 1res priodes du tableau
!
Des considrations semblables appliques aux couches 3
et 4 annoncent 18 et 32 lectrons respectivement, mais cela ne sÕaccorde pas
avec la rpartition des lments dans le tableau priodique. Et cÕest l tout
un problme : la 3e priode contient 8 lectrons au lieu de 18."
Et la 4e, ... 32?
"Tout
compte fait, les nombres quantiques paraissent fournir une explication
dductive satisfaisante du nombre total que chaque couche peut renfermer, mais
en revanche la correspondance de ces valeurs avec les nombres dÕlments dans
les priodes est en quelque sorte une concidence fortuite. LÕordonnance bien
connue du remplissage des orbitales spdf* (*diagramme manquant) a t
dtermine essentiellement de faon empirique. Bohr a chou dduire lÕordre
du remplissage des orbitales, et comme certains auteurs lÕont reconnu, cÕest l
un des grands problmes de la mcanique quantique.ÉConcernant le systme de
Mendeleev, la question nÕest plus de savoir sÕil est valide, mais plutt, de
trouver quelle serait la meilleure manire de le reprsenter**ÉÉ"
The rules that govern the assignment of quantum
numbers are rigorously explained by quantum theory, with the outcome that the
first 2 shells contain a maximum of 2 and 8 electrons—at long last an
explanation for the lengths of the first two periods of the table! Similar
considerations for the 3rd and 4th shells predict 18 and 32 electrons
respectively, but this is not in accordance with the arrangement of the
elements in the periodic table.The problem is this: the third row of the
periodic table contains 8, not 18, electrons.
It turns out that while quantum numbers provide a
satisfying deductive explanation of the total number of electrons that any
shell can hold, the correspondence of these values with the number of elements
that occur in any particular period is something of a coincidence. The familiar
sequence in which the s, p, d, and f orbitals are filled (see diagram, left)
has essentially been determined by empirical means. Indeed, BohrÕs failure to
derive the order for the filling of the orbitals has been described by some as
one of the outstanding problems of quantum mechanics.ÉThe problem is no longer
the validity of MendeleevÕs system, but the best way to represent it.
NDLR. ** La validit du sytme de Mendlev est-elle
vraiment hors de question? La reprsentation serait-elle donc sans grande
importance dans un systme tel que celui de Mendeleev ? Un systme reprsent
par un tableau est du fait mme ncessairement associ la topologie, la
gomtrie et la thorie quantique ; toutes disciplines que jÕinvoque dans le
systme du qubcium. LÕintroduction dÕune reprsentation nouvelle peut
conduire rviser cette thorie, encore aujourd'hui insuffisante. - Il nÕy a
pas un tableau idal unique, une multitude de tableaux sont possibles qui sont
scientifiquement corrects, mais ingaux devant notre besoin de comprendre la
structure de lÕatome et en particulier sa symtrie dÕordre 4. Le systme du
qubcium et ses tableaux, la diffrence de ce qui tait admis jusquÕici, mettent
en vidence pour la 1re fois cette symtrie et proposent une comprhension
meilleure de lÕorganisation de lÕatome.
Rf. 3. 565) Systme du
Qubcium. ![]() Patrick Callet 2014,
Patrick Callet 2014,
Rf. 4. Maurice
Kibler 2014. 563) Systme du Qubcium. ![]() Maurice Kibler 2014, Pierre
Demers, Centenaire, lisulf.quebec/2_allocutionKibler.htm
Maurice Kibler 2014, Pierre
Demers, Centenaire, lisulf.quebec/2_allocutionKibler.htm
![]() Maurice Kibler 2014, Pierre
Demers, Centenaire, lisulf.quebec/2_allocutionKibler.pdf
Maurice Kibler 2014, Pierre
Demers, Centenaire, lisulf.quebec/2_allocutionKibler.pdf
Rf. 5. Pierre Demers 2010, http://lisulf.quebec/ObtenirACFAS30XI2010.htm
Rf. 6. Eric Scerri, http://www.chem.ucla.edu/dept/Faculty/scerri/
