
QbSyst2e.16.html
Système du Québécium
Suivant QbSyst2e.17.html
Précédent
QbSyst2e.15.htmlDébut QbSyst2e.1.html
Chapitre 8
Applications aux éléments
L'atomogénèse

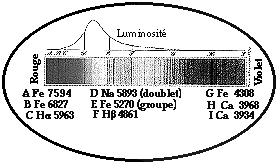
Figs 190, 191. Dessin coloré célèbre de Fraunhofer en 1819 décrivant 9 raies dans le spectre du Soleil. Longueur d'onde
l en Angtröms A° = 10-7 cm.Buts du présent chapitre.
Il nous faut d'abord constater que la matière que nous connaissons est la même partout dans l'univers. C'est ce que commencèrent de démontrer les raies spectrales observées par Fraunhofer dans la lumière du soleil. Bunsen attribua les 9 raies aux éléments indiqués : fer, hydrogène, sodium et calcium. Figures 190, 191.
Ainsi commença notre connaissance des éléments à l'extérieur de la Terre. On a maintenant reconnu dans le spectre du Soleil 26000 raies, toutes identifiées et attribuées à 70 des éléments connus sur terre. Dans les spectres luminneux des étoiles et des autres corps célestes, on reconnaît aussi des raies. Toutes sont attribuables à l'un des éléments décrits dans ce chapitre, dont les numéros atomiques Z sont compris entre 1 et 118.
Les éléments sont les mêmes partout dans l'univers.
Il nous faut ensuite reconnaître que l'organisation électronique de chacun des éléments découle de celle du québécium. Cette organisation se décrit par le nombre des électrons et par les caractères de ceux-ci. Voyons en premier lieu le nombre des électrons, nous verrons ensuite leurs caractères qui assignent une formule électronique à chaque élément.

Fig. 192. Schéma d'un atome : un noyau Z fois positif, contenant Z protons, et Z électrons formant un nuage Z fois négatif. Le tout est électriquement neutre.

Fig. 193. Genèse additive, genèse soustractive.
Les nombres d'électrons des éléments.
Les 118 électrons du québécium.
Le québécium a le numéro atomique Z = 118 : autour d'un noyau renfermant 118 protons, il compte 118 électrons. Les autres atomes qui nous intéressent ont moins de 118 électrons, leur numéro atomique est compris entre 118 et 1.
Rappelons que les atomes comprennent un noyau très petit ayant Z charges positives et un nuage négatif de Z électrons entourant le noyau et totalisant Z charges négatives. Figure 192.
Les atomes connus et réalisés dans la nature ou au laboratoire vont de Z = 1 à Z = 112. Au-delà, ils sont spéculatifs, à cause de l'instabilité des noyaux contenant un grand nombre de protons. On peut arrêter leur liste à 118 parce que ce serait un gaz rare selon l'extrapolation dans le tab;eau de Mendeleev, ou plus loin. Certaines théories prévoient une "vallée" de stabilité nucléaire au voisinage de Z = 120.

Fig. 194. "Poussières d'étoiles", spectacle à succès à Paris de Philippe Cortin, d'après l'oeuvre de même titre d'Hubert Reeves.
Nombre d'électrons. Il est clair qu'en enlevant à un atome de québécium des électrons en nombre suffisant, on obtient le nombre d'électrons voulus pour constituer tout autre atome. C'est une genèse soustractive ou simplificatrice des éléments. Figure 193.
On peut aussi bien procéder en sens inverse, à partir de l'atome d'hydrogène : on lui ajoute le nombre voulu d'électrons et on obtient l'atome de numéro atomique Z. C'est une genèse additive. Genèse additive est une appellation nouvelle pour ce qu'on appelle souvent "construction".
Ces genèses sont virtuelles. Elles nous servent à présenter et à expliquer l'organisation des atomee. Il faut que le noyau évolue en charge positive pour assurer la neutralité de l'atome engendré, mais nous voulons insister sur le rôle des électrons dans les atomes.
Nous nous attachons à la genèse soustractive et nous justifierons plus loin cet attachement par des considérations de caractère quantique.
"Le québécium est à l'origine de tous les éléments de l'univers".
Ce qui précède nous permet de dire que le québécium est virtuellement à l'origine de tous les éléments de l'univers.
Du fait des 118 électrons qu'il renferme, le québécium possède une valeur universelle, puisqu'il contient virtuellement toute la matière atomique de l'univers. Par la genèse soustractive, il donne naissance à toutes les sortes d'atomes de la matière, de la plus lointaine comme de la plus proche.
Genèses atomiques et nucléaires,
virtuelles et réelles.
Ne confondons pas la genèse atomique ci-dessus ou "atomogénèse" avec la genèse des noyaux atomiques ou "nucléogénèse". L'atomogénèse décrite concerne le cortège d'électrons autour des noyaux. Nous la considérons comme virtuelle mais il est entendu qu'elle peut aussi être réelle.
La nucléogénèse reçoit présentement une publicité considérable et bien justifiée, mais ce n'est pas spécialement d'elle que nous devons parler dans ce chapitre.
La nucléogénèse cosmique, bien réelle dans le monde distant qui nous entoure, fait apparaître les noyaux des atomes et met en jeu des phénomènes célestes, soleils, étoiles et galaxies. La nucléogénèse proprement dite est indifférente aux électrons. On la trouve décrite et illustrée dans l'opéra cosmique "Poussières d'étoiles" créé d'après le livre du même nom d'Hubert Reeves. On peut souhaiter que cet opéra soit transporté à Montréal, par exemple dans le grand hall de l'édifice Desjardins. Figure 194.
La nucléogénèse procède à partir d'atomes d'hydrogène et plus précisément de protons. Elle est principalement additive : les processus célestes fabriquent à partir des protons des noyaux plus lourds. Au cours de leur évolution, les étoiles s'enrichissent en atomes lourds. Figure 194.
Sans la nucléogénèse, on n'observerait pas la diversité des atomes que l'on connaît. Pour obtenir réellement un atome ayant Z électrons, il faut disposer d'un noyau ayant Z charges positives. Le cortège de Z électrons s'ajuste au noyau pour donner un atome neutre. L'atomogénèse complète la nucléogénèse.
La nucléogénèse est encore réelle sur terre, à une échelle modeste, dans les phénomènes naturels dus au rayonnement cosmique et à la radioactivité et dans les phénomènes provoqués artificiellement dans les laboratoires. Dans ces phénomènes, des noyaux atomiques perdent ou gagnent des charges positives. Puis le cortège d'électrons s'ajuste pour donner un atome neutre afin de compléter l'atomogénèse.
Les électrons de l'atomogénèse.
Il est tout à fait remarquable que les électrons nécessaires pour compléter l'atomogénèse soient si facilement disponibles dans l'univers et surtout sur la terre, sinon, les objets seraient chargés positivement autour de nous. En fait, il arrive que des objets aient une charge nette autour de nous, soit positive par carence d'électrons, soit négative par leur surabndance ou leur présence à l'état libre, et il s'ensuit des météores visibles : aurores boréales, éclairs, foudre en boule, elfes. Les électrons sont disponibles dans les étoiles puisqu'on observe, même dans les plus chaudes, les spectres d'atomes neutres.
Les oïdes.
Il faut mentioner le cas des ions atomiques, obtenus à partir d'un atome par addition ou soustraction d'électrons. Leur charge nette n'est pas nulle : ions positifs où les électrons sont moins nombreux que les protons du noyau et ions négatifs dans le cas contraire. Par leurs propriétés spectroscopiques, ils ressemblent aux atomes neutres ayant le même nombre d'électrons.
On les appelle des "oïdes". Un hydrogénoïde a un seul électron, un hélioïde en a 2, un néonoïde en a 10 etc. Dans le soleil, on connaît l'hydrogénoïde provenant de l'atome de fer ionisé 25 fois et ne retenant qu'un électron. On le note Fe25+ ou FeXXVI.
Mais il nous faut raffiner nos considérations ci-dessus en tenant compte de données de caractère quantique touchant les atomes : les caractères des électrons. Ce raffinement n'affecte pas la validité de l'énoncé ci-dessus.

Fig. 195. Légende. Voici comment on écrit les valeurs de nlms définissant le caractère d'un électron dans un atome. Référence Tableaux 49, 50 etc. Remarquez : un 1er nombre, une lettre, un 2e nombre, un signe. Le 2e nombre peut être négatif.
Tableau 49. Les nombres quantiques des électrons.
nlms
n principal
l azimutal
m magnétique
s de spin
Tableau 50. L'alphabet quantique des électrons
Valeurs du quantum azimutal l : l'une de 4 lettres
s pour l = 0
p pour l = 1
d pour l = 2
f pour l = 3
Les caractères des électrons.
Configuration électronique du québécium.
Configurations électroniques des atomes.
Les électrons libres sont tous semblables. Mais dans un atome, retenus par le noyau positif, les électrons sont tous différents. Il n'y en a pas 2 semblables. Ils différent par leurs caractères, eux-mêmes définis par les valeurs de 4 nombres quantiques appelés n, l, m, s, que nous écrivons de préférence sans les virgules afin de marquer leur très nécesaire association : nlms. C'est une donnée de l'observation des spectres atomiques interprétée dans la théorie des quanta. Nous les utilisons sans chercher à justifier leur existence. Voici ces importants nombres quantiques. Tableau 49.
On utilise les notations de la spectroscopie pour désigner les valeurs de nlms, selon la légende. Figure 195.
Pour alléger le texte, les indications détaillées sur nlms sont rejetées à l'Annexe A en fin de ce chapitre.
La liste des caractères des électrons présents dans un atome est appelée configuration électronique ou formule électronique de cet atome. Les électrons sont numérotés par des numéros d'ordre de 1 à Z. Le québécium a ainsi sa configuration ou sa formule électronique, dans une liste comprenant 118 numéros de 1 à 118. Tableau 51.Cette liste provient de l'expérience et de l'extrapolation. Répertoire.
Chaque élément Z a sa propre liste et sa propre configuration électronique. Exemples l'américium Am 95 et le francium Fr 87. Tableaux 52, 53.
Tableau 51. Formule du québécium
Numéros électroniques 1 à 118
Numéros
| 1 à 10 |
1s0- | 1s0+ | 2s0- | 2s0+ | 2p-1- | 2p0- | 2p1- | 2p-1+ | 2p0+ | 2p1+ |
|
11 à 20 | 3s0- | 3s0+ | 3p-1- | 3p0- | 3p1- | 3p-1+ | 3p0+ | 3p1+ | 4s0- | 4s0+ |
|
21 à 30 | 3d-2- | 3d-1- | 3d0- | 3d1- | 3d2- | 3d-2+ | 3d-1+ | 3d0+ | 3d1+ | 3d2+ |
|
31 à 40 | 4p-1- | 4p0- | 4p1- | 4p-1+ | 4p0+ | 4p1+ | 5s0- | 5s0+ | 4d-2- | 4d-1- |
|
41 à 50 | 4d0- | 4d1- | 4d2- | 4d-2+ | 4d-1+ | 4d0+ | 4d1+ | 4d2+ | 5p-1- | 5p0- |
|
51 à 60 | 5p1- | 5p-1+ | 5p0+ | 5p1+ | 6s0- | 6s0+ | 4f-3- | 4f-2- | 4f-1- | 4f0- |
|
61 à 70 | 4f1- | 4f2- | 4f3- | 4f-3+ | 4f-2+ | 4f-1+ | 4f0+ | 4f1+ | 4f2+ | 4f3+ |
|
71 à 80 | 5d-2- | 5d-1- | 5d0- | 5d1- | 5d2- | 5d-2+ | 5d-1+ | 5d0+ | 5d1+ | 5d2+ |
|
81 à 90 | 6p-1- | 6p0- | 6p1- | 6p-1+ | 6p0+ | 6p1+ | 7s0- | 7s0+ | 5f-3- | 5f-2- |
|
91 à 100 | 5f-1- | 5f0- | 5f1- | 5f2- | 5f3- | 5f-3+ | 5f-2+ | 5f-1+ | 5f0+ | 5f1+ |
|
101 à 110 | 5f2+ | 5f3+ | 6d-2- | 6d-1- | 6d0- | 6d1- | 6d2- | 6d-2+ | 6d-1+ | 6d0+ |
|
111 à 118 | 6d1+ | 6d2+ | 7p-1- | 7p0- | 7p1- | 7p-1+ | 7p0+ | 7p1+ |
Observation fondamentale.
Or il se trouve que la configuration de chaque élément se trouve comprise dans celle du québécium. Cela est une donnée de l'expérience, qui évidemment importe énomément dans l'atomogénèse. Non seulement le québécium renferme-t'il assez d'électrons pour que tout élément y trouve son compte, mais encore il les renferme avec les caractères nécessaires.
Ciel! Pas de pile!
Fig. 196. Les avertisseurs de fumée utilisent l'américium.
Il faut remarquer qu'à priori cette donnée n'est nullement évidente. Elle découle de l'expérience.
Nous pouvons écrire l'énoncé ci-dessus dans la notation de la théorie des ensembles, usant du symbole "contenu dans" ou "contient". Le québécium contient tout élément quant aux configurations électroniques.
québécium
É tout élément(configurations électroniques)
Pourquoi choisir la genèse soustractive.
Si nous choisssons la genèse additive, il nous faut constamment recourir à une liste et déclarer quel est le caractère que l'électron à ajouter doit prendre afin d'établir la configuration de cet élément.
Si nous optons en faveur de la genèse soustractive, une liste d'ensemble est établie d'avance une fois pour toutes et il suffit d'en retirer les entrées inutiles. Cette liste d'ensemble est celle du québécium. Voici les régles de cette genèse. La 1re est générale. Selon le cas et d'après l'expérience, c'est ensuite soit la 2e ou la 2e bis qu'il faut choisir.
Genèse soustractive. Règle 1. Pour obtenir la configuration d'un élément Z, il faut conserver Z entrées dans la configuration du québécium.
Genèse soustractive. Règle 2. Configuration nominale. Éléments normaux. Les entrées à conserver vont de 1 à Z consécutivement. Le résultat est la configuration nominale de l'élément. L'expérience a montré que cette règle donne la configuration réelle dans la plupart des cas, pour les éléments appelés normaux. Sinon la règle 2bis s'applique.
Genèse soustractive. Règle 2 bis. Éléments exceptionnels. Dans le cas des éléments exceptionnels, les entrées à conserver sont au nombre de Z mais elles ne sont pas consécutives. Certaines sont absentes et leurs emplacements sont appelés lacunes. Les entrées conservées vont de 1 jusqu'à une valeur supérieure à Z avec des lacunes.
Simulation des genèses soustractives. Création d'ions positifs.
Il n'est pas facile de réaliser à volonté la genèse soustractive faisant passer d'un atome Z à un atome Z-1. Cependant, il est facile d'en observer des exemples partiels au laboratoire et même dans la vie courante. Tous les atomes se prêtent en effet à l'ionisation par enlèvement d'un électron. Il apparaît alors, pour une durée plus ou moins longue, un oïde de l'atome Z-1 qu'on appelle ion positif, ce qui est marqué par le signe + suivant le symbole de l'atome. Cet oïde a Z-1 électrons et simule par là un atome Z-1 mais possède encore Z charges positives dans son noyau. Par certaines de ses propriétés, il ressemble à l'atome Z-1.
Il lui ressemble d'autantplus que les Z-1 électrons résiduels réalisent la configuration électronique de l'atome Z-1.
En effet, les efforts pour enlever un électron à un atome enlèvent invariablement l'électron qui serait en trop pour assurer la configuration de l'atome Z-1. C'est ce qui ressort des tables disponibles sur les potentiels de première ionisation ppi. Les valeurs des ppi apparaissent aux figures 285 du Chapitre 14.
Il y a là simulation d'une atomogeénèse soustractive, incomplète puisqu'elle n'affecte pas la charge positive du noyau .
Au lieu de 1 ci-dessus dans Z-1, on peut écrire 2, 3 etc et simuler la genèse soustractive des éléments Z-2, Z-3, etc. Un exemple est le cas connu Z-15 avec Z = 26 qui simule la genèse soustractive de Na11 à partir de Fe26.
Un exemple commensal est celui des éclairages fluorescents ou "néons", où le mercure Hg Z = 80 devient temporairement l'ion Hg+ qui est l'oïde de Au Z = 79 et en recouvrant l'électron issu de son ionisation, détermine l'émission de rayonnements excitant les fluorescences qui nous éclairent. Il y a simulation de la nucléogénèse de l'or Au. Mais il n'y a pas genèse d'or, le noyau reste celui du mercure.
Des exemples plus discrets assurent l'éclairage électrique. Ils nous entourent, ils sont statiques et permanents. Ils concernent la conduction de l'électricité par les métaux. Les métaux doivent leur conductibilité électrique à leur ionisation permanente lorsqu'ils sont à l'état solide ou liquide. Ils sont des réseaux d'ions positifs baignés par des électrons et le déplacement de ces électrons transporte l'électricité. Une goutte de mercure est composée de noyaux retenant 79 électrons aussi bien que le fait un atome Au neutre, et d'électrons. Il y a simulation de la genèse de l'or à partir du mercure. Semblablement, un câble de cuivre ou d'aluminium simule la genèse de l'atome de nickel ou de silicium respectivement, un objet d'argenterie, la genèse de l'atome de palladium.
Une solution de sel NaCl dans l'eau est remplie d'ions Na+ qui simulent l'atome Ne par leur nombre d'électrons. Le sodium a donné son électron au chlore qui est devenu l'ion négatif Cl- , oïde de l'argon A par le nombre d'électrons. La création de Cl- simule une atomogénèse additive. Ces ions sont mobiles et rendent la solution conductrice. L'océan présente un exemple de grande envergure de ce phénomène.
Un cristal de NaCl est un agencement d'ions Na+ et Cl-. Les ions Na+ simulent, là aussi, l'atome Ne.
Genèses à partir de l'américium et du francium.
Afin de mieux faire comprendre en quoi consiste le processus de la genèse soustractive, nous envisageons ce processus appliqué à partir d'un élément autre que le virtuel québécium, par exemple, du bien connu et bien réel américium Am 95, qui contient 95 électrons, selon une liste tirée du Tableau 51 avec raccourcissement. Tableau 52.
Tableau 52. Formule de l'américium
Numéros électroniques 1 à 95
Numéros
| 1 à 10 | 1s0- | 1s0+ | 2s0- | 2s0+ | 2p-1- | 2p0- | 2p1- | 2p-1+ | 2p0+ | 2p1+ |
|
11 à 20 | 3s0- | 3s0+ | 3p-1- | 3p0- | 3p1- | 3p-1+ | 3p0+ | 3p1+ | 4s0- | 4s0+ |
|
21 à 30 | 3d-2- | 3d-1- | 3d0- | 3d1- | 3d2- | 3d-2+ | 3d-1+ | 3d0+ | 3d1+ | 3d2+ |
|
31 à 40 | 4p-1- | 4p0- | 4p1- | 4p-1+ | 4p0+ | 4p1+ | 5s0- | 5s0+ | 4s-2- | 4d-1- |
|
41 à 50 | 4d0- | 4d1- | 4d2- | 4d-2+ | 4d-1+ | 4d0+ | 4d1+ | 4d2+ | 5p-1- | 5p0- |
|
51 à 60 | 5p1- | 5p-1+ | 5p0+ | 5p1+ | 6s0- | 6s0+ | 4f-3- | 4f-2- | 4f-1- | 4f0- |
|
61 à 70 | 4f1- | 4f2- | 4f3- | 4f-3+ | 4f-2+ | 4f-1+ | 4f0+ | 4f1+ | 4f2+ | 4f3+ |
|
71 à 80 | 5d-2- | 5d-1- | 5d0- | 5d1- | 5d2- | 5d-2+ | 5d-1+ | 5d0+ | 5d1+ | 5d2+ |
|
81 à 90 | 6p-1- | 6p0- | 6p1- | 6p-1+ | 6p0+ | 6p1+ | 7s0- | 7s0+ | 5f-3- | 5f-2- |
|
91 à 95 | 5f-1- | 5f0- | 5f1- | 5f2- | 5f3- |
Tableau 53. Formule du francium
Numéros électroniques1 à 87
Numéros
| 1 à 10 | 1s0- | 1s0+ | 2s0- | 2s0+ | 2p-1- | 2p0- | 2p1- | 2p-1+ | 2p0+ | 2p1+ |
|
11 à 20 | 3s0- | 3s0+ | 3p-1- | 3p0- | 3p1- | 3p-1+ | 3p0+ | 3p1+ | 4s0- | 4s0+ |
|
21 à 30 | 3d-2- | 3d-1- | 3d0- | 3d1- | 3d2- | 3d-2+ | 3d-1+ | 3d0+ | 3d1+ | 3d2+ |
|
31 à 40 | 4p-1- | 4p0- | 4p1- | 4p-1+ | 4p0+ | 4p1+ | 5s0- | 5s0+ | 4s-2- | 4d-1- |
|
41 à 50 | 4d0- | 4d1- | 4d2- | 4d-2+ | 4d-1+ | 4d0+ | 4d1+ | 4d2+ | 5p-1- | 5p0- |
|
51 à 60 | 5p1- | 5p-1+ | 5p0+ | 5p1+ | 6s0- | 6s0+ | 4f-3- | 4f-2- | 4f-1- | 4f0- |
|
61 à 70 | 4f1- | 4f2- | 4f3- | 4f-3+ | 4f-2+ | 4f-1+ | 4f0+ | 4f1+ | 4f2+ | 4f3+ |
|
71 à 80 | 5d-2- | 5d-1- | 5d0- | 5d1- | 5d2- | 5d-2+ | 5d-1+ | 5d0+ | 5d1+ | 5d2+ |
|
81 à 90 | 6p-1- | 6p0- | 6p1- | 6p-1+ | 6p0+ | 6p1+ | 7s0- |
Bien connu ou méconnu, mais l'américium est du moins omniprésent, car il sert dans les avertisseurs de fumée obligatoires dans toutes les maisons. Figure 196.
En partant de l'américium, on peut expliquer la genèse virtuelle de tous les éléments Z < 95 par un processus soustractif. En enlevant 85 électrons, on obtendrait ainsi le néon Ne10, etc.
Semblablement, nous pouvons envisager une genèse partant du francium, basée sur le francium Fr87 qui contient 87 électrons selon la liste du Tableau 53 extraite du Tableau 51. Cette genèse atteint tous les éléments Z < 87 par un processus soustractif. En enlevant 69 électrons, on obtiendrait ainsi l'argon A18, etc.
Il y a une raison de préférer comme élément de départ le québécium à l'américium ou au francium. Étant un gaz rare, il constitue, selon les traditions établies, le terme de la dernière période d'éléments connus et sa formule renferme celle de tous les éléments y compris ceux de cette dernière période. Ce n'est pas le cas si l'élément de départ est de numéro atomique inférieur à 118.
Grille du québécium, formule du québécium.
Tout ce que nous avons proposé dans le présent chapitre est indépendant de l'usage de la grille du québécium de 4 strates et 120 cases définie mathématiquement au Chapitre 1. Nous montrons cependant cette grille, mise à profit pour montrer une fois de plus la formule du québécium. Comme celle-ci n'occupe que 118 des 120 cases disponibles, nous laissons vides les 2 cases de numéros 119 et 120. Les numéros des cases sont ceux de la figure 13. Fig. 197.
Nous reconnaissons que la grille du québécium se prête à loger la formule complète du québécium, un électron par case.
Le placement des électrons est fait ici dans l'ordre de numéros électroniques en utilisant la numérotation des cases de la figure 13. D'autres placements sont possibles et pourraient être avantageux.
Lesquels?
C'est ce que nous examinerons au chapitre suivant
Nota-bene. C'est le tableau des électrons du québécium.
La figure 197 n'est pas un tableau des éléments, bien que l'on puisse s'en servir afin de pratiquer la genèse de ceux-ci.
Elle est un tableau donnant la formule du québécium .


Fig. 197. Tableau. Grille du québécium (fig. 13) montrant la formule du québécium. 118 cases utilisées sur 120. Numéros des cases, numéros électroniques.
Genèse et vêlage.
À propos de genèse, nous proposons le terme de vêlage. Voici pourquoi. Vêlage s'applique à la vache mettant au monde un veau, aux banquises flottantes et aux glaciers de marée. En se jetant à la mer, un glacier de marée perd sous la forme d'icebergs, quand la marée descend, les fragments qui lui sont le plus faiblement attachés et réduit sa masse. On dit que le glacier vêle. On rencontre de tels glaciers au voisinage du Québec, sur la terre de Baffin et au Groënland.
Or le Québec a un passé glaciologique encore récent, remontant à moins de 10000 ans, alors que sa couverture de glaces éternelles vêlait dans ce qui est devenu le fleuve Saint-Laurent. Il en garde un souvenir concret, renouvelé annuellement. En effet, 4 ou 5 mois par année, une carapace de glace périssable revêt ses lacs et ses rivières. Cette carapace se disloque à chaque printemps dans un processus appelé couramment débâcle, qui rappelle le vêlage des glaciers de marée, libérant des glaçons emportés vers l'océan Atlantique, la baie James ou la baie d'Hudson. L'analogie est comme suit. Tableau 54.
Tableau 54. Genèse et vêlage.
.........
Glacier intact.......................... Québécium.........
Iceberg vêlé, icebergs vêlés.........Électrons libérés.........
Glacier diminué.........L'élément résultantL'analogie possède une valeur pédagogique et imaginative, rattachant le système du Québécium à l'histoire géologique du Québec, ancienne et actuelle. Elle est imparfaite : glaciers, icebergs, carapace de glace et glaçons ont une existence éphémère. Elle pourra présenter un attrait pour ceux que le Québec et l'histoire du Québec intéressent. Réf. Le vêlage du Québécium, générateur des éléments. Pierre Demers. PUM 1999 885, 1427PierreDemersBibl1990-9.html
Annexe A. Les nombres quantiques nlms.
L'atome d'hydrogène a fait l'objet d'une théorie universellement acceptée, due principalement à Schrödinger. Cette théorie définit 4 nombres quantiques n, l, m, s attribués à l'unique électron de cet atome, ayant des relations entre eux.
Cette théorie ne s'applique pas telle quelle aux autres atomes sauf en 2 points : l'existence pour chaque électron des 4 nombres quantiques nlms et l'existence des relations mentionnées. Tableau 54.
Nous appellerons théorie normale celle qui résulte le plus immédiatement de la théorie ci-dessus. Selon cette théorie normale, les caractères des électrons du québécium seraient ceux du Tableau 55 et se succéderaient dans l'ordre indiqué. La formule connue du québécium représente une sélection et un remaniement parmi les valeurs de ce tableau.
Tableau 54. Vocabulaire.
Les valeurs permises de nlms.
n nombre entier, nombre quantique principal, quantum principal, une valeur de n désigne une couche
l nombre entier ou 0, nombre quantique azimutal, quantum azimutal,
un doublet de valeurs (n, l) désigne une sous-couche
l < n
m nombre entier positif, négatif ou 0, nombre quantique magnétique ou quantum magnétique,
un triplet de valeurs (n, l, m) désigne une orbitale
|m|
inférieur ou égal à ls spin, nombre quantique de spin, quantum de spin vaut - ou +
- s'écrit au lieu de -1/2, + s'écrit au lieu de 1/2
un quadruplet de valeurs (n, l, m, s) désigne un caractère
Tableau 55.
Théorie normale de
l'atome. Formule
prévue du
québécium Ce tableau
a 140 lignes occupées, 280
caractères permis
| Couche K | Couche O | Couche P | Couche Q |
| n ..... l .....m .....s | n ..... l .....m .....s | n ..... l .....m .....s | n ..... l .....m .....s |
|
1.....0.....0.....-, + | 5 ..... 0 ..... 0 ..... -, + | 6 ..... 0 ..... 0 ..... -, + | 7 ..... 0 ..... 0 ..... -, + |
|
|
..... 1 ..... -1 ..... -, + | ..... 1 ..... -1 ..... -, + | ..... 1 ..... 0 ..... -, + |
| Couche L |
..... ..... 0 ..... -, + | ..... ..... 0 ..... -, + | ..... ..... -1..... -, + |
| n ..... l .....m .....s | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + |
|
2.....0 ..... 0 ..... -, + | ..... 2 ..... 0 ..... -, + | ..... 2 ..... 0 ..... -, + | ..... 2 ..... 0 ..... -, + |
| ..... 1 ..... 0 ..... -, + | ..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + |
| ..... ..... -1 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + |
|
..... ..... 1 ..... -, + | ..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + |
|
|
..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + |
| Couche M |
..... 3 ..... 0 ..... -, + | ..... 3 ..... 0 ..... -, + | ..... 3 ..... 0 ..... -, + |
| n ..... l .....m .....s | ..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + |
|
3 ..... 0 ..... 0 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + |
| ..... 1 ..... 0 ..... -, + | ..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + |
|
..... ..... -1 ..... -, + | ..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + |
|
..... ..... 1 ..... -, + | ..... ..... -3 ..... -, + | ..... ..... -3 ..... -, + | ..... ..... -3 ..... -, + |
|
..... 2 ..... 0 ..... -, + | ..... ..... 3 ..... -, + | ..... ..... 3 ..... -, + | ..... ..... 3 ..... -, + |
|
..... ..... -1 ..... -, + | ..... 4 ..... 0 ..... -, + | ..... 4 ..... 0 ..... -, + | ..... 4 ..... 0 ..... -, + |
| ..... ..... 1 ..... -, + | ..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + |
| ..... ..... -2 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + |
|
..... ..... 2 ..... -, + | ..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + |
|
|
..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + |
| Couche N |
..... ..... -3 ..... -, + | ..... ..... -3 ..... -, + | ..... ..... -3 ..... -, + |
| n ..... l .....m .....s | ..... ..... 3 ..... -, + | ..... ..... 3 ..... -, + | ..... ..... 3 ..... -, + |
| 4 ..... 0 ..... 0 ..... -, + |
..... ..... -4 ..... -, + | ..... ..... -4 ..... -, + | ..... ..... -4 ..... -, + |
|
..... 1 ..... 0 ..... -, + | ..... ..... 4 ..... -, + | ..... ..... 4 ..... -, + | ..... ..... 4 ..... -, + |
|
..... ..... -1 ..... -, + | , |
..... 5 ..... 0 ..... -, + | ..... 5 ..... 0 ..... -, + |
|
..... ..... 1 ..... -, + | , |
..... ..... -1 ..... -, + | ..... ..... -1 ..... -, + |
|
..... 2 ..... 0 ..... -, + | , |
..... ..... 1 ..... -, + | ..... ..... 1 ..... -, + |
|
..... ..... -1 ..... -, + | , |
..... ..... -2 ..... -, + | ..... ..... -2 ..... -, + |
|
..... ..... 1 ..... -, + | , |
..... ..... 2 ..... -, + | ..... ..... 2 ..... -, + |
|
..... ..... -2 ..... -, + | , |
..... ..... -3 ..... -, + | ..... ..... -3 ..... -, + |
|
..... ..... 2 ..... -, + | , |
..... ..... 3 ..... -, + | ..... ..... 3 ..... -, + |
|
..... 3 ..... 0 ..... -, + | , |
..... ..... -4 ..... -, + | ..... ..... -4 ..... -, + |
|
..... ..... -1 ..... -, + | , |
..... ..... 4 ..... -, + | ..... ..... 4 ..... -, + |
|
..... ..... 1 ..... -, + | , |
..... ..... -5 ..... -, + | ..... ..... -5 ..... -, + |
|
..... ..... -2 ..... -, + | , |
..... ..... 5 ..... -, + | ..... ..... 5 ..... -, + |
|
..... ..... 2 ..... -, + | , |
, |
..... 6 ..... 0 ..... -, + |
|
..... ..... -3 ..... -, + | , |
, |
..... ..... -1 ..... -, + |
|
..... ..... 3 ..... -, + | , |
, |
..... ..... 1 ..... -, + |
|
, |
, |
, |
..... ..... -2 ..... -, + |
|
, |
, |
, |
..... ..... 2 ..... -, + |
|
, |
, |
, |
..... ..... -3 ..... -, + |
|
, |
, |
, |
..... ..... 3 ..... -, + |
|
, |
, |
, |
..... ..... -4 ..... -, + |
|
, |
, |
, |
..... ..... 4 ..... -, + |
|
, |
, |
, |
..... ..... -5 ..... -, + |
|
, |
, |
, |
..... ..... 5 ..... -, + |
|
, |
, |
, |
..... ..... -6 ..... -, + |
|
, |
, |
, |
..... ..... 6..... -, + |
![]()
QbSyst2e.16.html
Système du Québécium
Suivant QbSyst2e.17.html
Précédent
QbSyst2e.15.htmlDébut QbSyst2e.1.html