
QbSyst2e.23quaterhtml
Système du Québécium Suivant QbSyst2e.23quinte.html
Précédent QbSyst2e.23bis.html
Voyez :
Un jeu de blocs qui enseigne la nouvelle classification des éléments
Pierre Demers, Québécium International
N. B. Pressés d'expérimenter avec les blocs, passez au Chapitre 3.
Chapitre 1
Introduction théorique
Atome d'hydrogène et atomes pluriélectroniques : ressemblances et dissemblances.
L'atome d'hydrogène et les atomes pluriélectroniques se ressemblent en ceci qu'ils contiennent un noyau chargé positivement entouré d'un cortège électronique négatif. Le diagramme classique de Grotrian montre une partie de ce que l'on connaît sur les états de l'atome d'hydrogène. FIGURE 1.
L'atome d'hydrogène est admirablement décrit par la théorie de Schroedinger et ses perfectionnements, mais la présence de plus d'un électron détermine des forces intraatomiques échappant à cette théorie. Ces forces lèvent des dégénérscences et augmentent le nombre des états possibles par un facteur 2 (effet de spin ou effet Pauli) et par un facteur prenant, selon le cas, les valeurs 1, 3, 5 ou 7 (effet Zeeman ou Zeeman-Stark).
L'atome d'hydrogène avec son électron unique et les atomes pluriélectroniques se ressemblent encore en ceci qu'il y a, dans l'un et dans les autres, plusieurs états ordonnés à considérer : dans l'atome d'hydrogène, ils sont successifs, l'électron unique pouvant prendre plusieurs états excités en plus de son état au repos : les symboles sont H, l'atome au repos, et H*, l'atome excité; dans les atomes pluriélectroniques, ces états sont simultanés dans l'atome au repos, chaque électron ayant un état distinct de tous les autres: les symboles sont la suite connue, avec un nombre z indiquant la charge du noyau et le nombre d'électrons après H1 : He2, Li3, B4... Qb118.

FIG. 1. Aperçu du diagramme classique de Grotrian de l'atome d'hydrogène. Voyez TABLEAU 2. Les états jusqu'à f ont des correspondances dans la suite des atomes pluriélectroniques.
Rappel. L'état d'un électron est défini par 4 nombres quantiques snlm : s qui peut être -1/2 ou +1/2, en abrégé - ou +, n, l, m, entiers compris entre -3 et +8. Nous supposons connue la notation de ces états, nous plaçons le spin - ou + en premier lieu.
Rappel. États de l'atome d'hydrogène. m ne se manifeste pas. Le spin avec son signe ne se manifeste pas dans un état s. Dans un état autre que s, le spin se manifeste et il est couplé au vecteur l de manière à donner un nombre quantique j qui vaut l-1/2 ou l+1/2. Le nombre j vaut 1/2 pour les états s.
Rappel. Orbitale. Les partenaires d'une orbitale ont même formule quant à nlm et ne diffèrent que par leur spin - ou +.
Rappel. Règle du constructivisme : dans la série des atomes pluriélectroniques, chacun provient du précédent par l'addition d'une charge positive au noyau et d'un électron nouveau; l'état de ce dernier électron ajouté caractérise le nouvel atome : c'est l'état caractéristique de l'atome résultant.
Ainsi, dans un langage abrégé, pour l'azote N7, l'état (caractéristique) est +2p0, l'azote est l'élément +2p0, il est un éléments 2p, il est un élément p; l'électron (caractéristique) de l'azote est +2p0.
La formule complète d'un élément z comprend z termes. Ainsi, celle du québécium Qb118, renferme 118 termes. Voici son début et sa fin. Dans l'encadré, chaque terme pourrait être muni de la valeur de z, celle-ci allant de 1 à 118. Voyez aussi TABLEAU 3.
[ -1s0, +1s0, -2s0, +2s0, -2p-1....+7p0, +7p+1 ]
Ainsi, chaque atome renferme les caractères de tous ceux qui l'ont précédé. Nous faisons usage des formules nominales, obtenues par suppression ordonnée des électrons contenus dans la formule du québécium à partir du dernier, suppression que nous avons appelée vêlage. Pour 18 atomes, la formule réelle diffère de la formule nominale et on l'obtient par une suppression sélective différente de la suppression ordonnée ci-avant : on conserve z électrons mais on enlève certains électrons de numéro inférieur à z. Ces atomes sont dits "exceptionnels", ils sont des "exceptions".
Correspondances : 1re tentative
Dans une hypothèse simple et simpliste, il y aurait corespondance un à un entre les états de l'atome d'hydrogène et les états caractéristiques des atomes. Or cela est grossièrement inexact dès le 1er état atomique rencontré, celui de l'hélium, et les états de l'hydrogène ne sont pas assez nombreux. Voici les 1ers termes de cette comparaison. TABLEAU 1.
TABLEAU 1. 1re comparaison des états.
................
Hydrogène .Atome pluriélectronique.....................
État........État ........Nom1er état
...........1s..........................2e état
..........-2p..........+1s0........He23e état
............2s...........-2s0.........Li34e état
..........+2p..........+2s0.........Be45e état
...........-3p..........-2p-1.......B56e état
............3s...........-2p0.........C6Etc
Chapitre 2
Les tableaux de données
Première amélioration
La comparaison du TABLEAU 1 est grandement améliorée par la considération des effets Pauli et Zeeman, ajoutant l'effet du spin aux états s et l'effet du quantum magnétique aux autres états. Nous obtenons alors le TABLEAU 2, qui renferme toutes les données dont nous avons besoin dans la suite.
Ce tableau énumère les états de l'hydrogène dans l'ordre, leurs numéros d'ordre apparaissant dans la colonne "lignes H". Il y a 32 états qui nous intéressent, les autres sont omis.
Source :
http://physics.nist.gov/cgi-bin/AtData/display.ksh?XXE0qHqIXXT2XXI
Cette source donne les valeurs des états en nombres d'onde. Seul nous importe l'ordre dans lequel ces valeurs se succèdent.
Les autres colonnes énumèrent les états électroniques dérivés théoriquement de celui de l'hydrogène par la levée de dégénérescence décrite. À l'intérieur de chaque ligne H, nous avons placé les états Qb par valeurs croissantes du spin et du quantum magnétique m. Cette convention a nécessité l'écriture de deux lignes Qb pour chacun des états s dérivés d'un état s de l'hydrogène. De la sorte, on compte 32 lignes H et 40 lignes Qb. Les lignes Qb sont des lignes électroniques.
Or il se trouve que la somme de ces états sur ces lignes Qb compose exactement la formule de l'encadré ci-dessus du québécium, chacun de ces états étant identifié par sa valeur de z.
Ces résultat est intéressant, cependant, même si le contenu de chaque ligne est correctement ordonné par une liberté de construction que nous avons exercée, la suite globale des lignes n'apparaît pas dans l'ordre requis. Il reste à comprendre pourquoi.
Dans la recherche d'une explication, nous pouvons remanier les lignes du TABLEAU 2 de façon à placer les valeurs de z en ordre. C'est le TABLEAU 3. On peut y lire tous les états électroniques composant la formule du québécium de l'encadré ci-dessus dans l'ordre corect.
TABLEAU 2. Les données
.Les lignes H sont celles des états successifs de l'hydrogène.
H
....................................................................................Lignes H..................
Les lignes Qb spin - et + sont distinctes............
Lignes Qb états électroniques correspondants.......1s
..........z=1.........2.................................................................1.............
-1s0..................................................................................................
+1s0.................................................................-2p
.........5.........6..........7.......................................................2...........
-2p-1...-2p0......-2p1....................................................2s
............3.........4...................................................................3............
-2s0.......................................................................................
+2s0..............................................................+2p
.........8...........9. ....10.......................................................4............
+2p-1...+2p0.....+2p1...................................................-3p
........13.........14.........15......................................................5............
-3p-1...-3p0......-3p1...................................................3s
...........11.....,..12..................................................................6............
-3s0...,.....................................................................................,..
+3s0................................................................-3d
..........21.......22........23.........24.......-25...............................7............
-3d-2...-3d-1....-3d0......-3d1.....-3d2............................+3p
........16........17........18.......................................................8...........
+3p-1...+3p0....+3p1.....................................................+3d
.........26........27........28.........29.........30.............................9............
+3d-2...+3d-1...+3d0.....+3d1.....+3d2............................-4p
..........31.......32........33......................................................10............
-4p-1....-4p0.....-4p1....................................................4s
...........19 ........20.................................................................11............
-4s0 ..........................................................................................
+4s0...............................................................-4d
.........39........40.........41........42.........43.............................12............
-4d-2....-4d-1....-4d0.....-4d1.....-4d2............................+4p
.........34........35.........36....................................................13.............
+4p-1...+4p0.....+4p1....................................................-4f
..........57.......58.........59........60.........61.........62........63......14............
-4f-3...-4f-2.....-4f-1....-4f0.......-4f1......-4f2.....-4f3......+4d
........44........45.........46.........47.........48............................15...........
+4d-2...+4d-1....+4d0.....+4d1.....+4d2..........................+4f
.........64........65.........66........67.........68........69.........70.....16............
+4f-3...+4f-2....+4f-1....+4f0......+4f1.....+4f2.....+4f3....-5p
.......49.........50..........51....................................................17............
-5p-1....-5p0.....-5p1...................................................5s
...........37........38.................................................................18............
-5s0..........................................................................................
+5s0...............................................................+5p
........52.........53........54.....................................................19............
+5p-1....+5p0....+5p1...................................................-5d
.........71........72.........73........74.......75...............................20............
-5d-2....-5d-1....-5d0.....-5d1....-5d2.............................+5d
........76........77.........78........79........80..............................21...........
+5d-2...+5d-1....+5d0....+5d1....+5d2.............................-5f
..........89.......90.........91.........92........93.........94........95......22...........
-5f-3.....-5f-2.....-5f-1.....-5f0.....-5f1......-5f2.....-5f3....+5f
.........96........97.........98........99........100.......101......102.....23............
+5f-3....+5f-2....+5f-1....+5f0....+5f1......+5f2....+5f3....-6p
.........81........82.........83....................................................24............
-6p-1....-6p0.....-6p1..................................................6s
...........55........56.................................................................25............
-6s0............................................................................................
+6s0...............................................................+6p
........84.........85........86.....................................................26............
+6p-1...+6p0.....+6p1...................................................-6d
.........103......104......105.......106.......107.............................27............
-6d-2....-6d-1....-6d0....-6d1......-6d2.............................+6d
.......108......109.......110.......111.......112.............................28...........
+6d-2...+6d-1....+6d0....+6d1.....+6d2............................-7p
........113.......114.......115...................................................29............
-7p-1....-7p0.....-7p1...................................................7s
...........87.........88................................................................30............
-7s0............................................................................................
+7s0...............................................................+7p
.......116......117.......118.....................................................31...........
+7p-1...+7p0.....+7p1....................................................8s
..........119......120.................................................................32............
-8s0........................................................................................
+8s0...............................................................
TABLEAU 3. Les données
. Mise en ordre selon z.Les lignes H sont celles des états successifs de l'hydrogène.
H
....................................................................................Lignes H..................
Les lignes Qb spin - et + sont distinctes............
Lignes Qb états électroniques correspondants.......-------------------------------------------------------------------------
..........
Strate 11s
..........z=1.........2.................................................................1.............
-1s0...........................................................................................
+1s0.................................................................2s
............3.........4...................................................................3............
-2s0........................................................................................
+2s0..............................................................-------------------------------------------------------------------------
..........
Strate 2-2p
.........5.........6..........7.......................................................2...........
-2p-1...-2p0......-2p1....................................................+2p
.........8...........9. ....10.......................................................4............
+2p-1...+2p0.....+2p1...................................................3s
...........11.....,..12..................................................................6............
-3s0...,......................................................................................,..
+3s0................................................................-3p
........13.........14.........15......................................................5............
-3p-1...-3p0......-3p1...................................................+3p
........16........17........18.......................................................8...........
+3p-1...+3p0....+3p1.....................................................4s
...........19 ........20.................................................................11............
-4s0 .....................................................................................
.....+4s0...............................................................-------------------------------------------------------------------------
..........
Strate 3-3d
..........21.......22........23.........24.......-25...............................7............
-3d-2...-3d-1....-3d0......-3d1.....-3d2............................+3d
.........26........27........28.........29.........30.............................9............
+3d-2...+3d-1...+3d0.....+3d1.....+3d2............................-4p
..........31.......32........33......................................................10............
-4p-1....-4p0.....-4p1....................................................+4p
.........34........35.........36....................................................13.............
+4p-1...+4p0.....+4p1....................................................5s
...........37........38.................................................................18............
-5s0...........................................................................................
+5s0...............................................................-4d
.........39........40.........41........42.........43.............................12............
-4d-2....-4d-1....-4d0.....-4d1.....-4d2............................+4d
........44........45.........46.........47.........48............................15...........
+4d-2...+4d-1....+4d0.....+4d1.....+4d2..........................-5p
.......49.........50..........51....................................................17............
-5p-1....-5p0.....-5p1...................................................+5p
........52.........53........54.....................................................19............
+5p-1....+5p0....+5p1...................................................6s
...........55........56.................................................................25............
-6s0...........................................................................................
+6s0...............................................................-------------------------------------------------------------------------
..........
Strate 4-4f
..........57.......58.........59........60.........61.........62........63......14............
-4f-3...-4f-2.....-4f-1....-4f0.......-4f1......-4f2.....-4f3......+4f
.........64........65.........66........67.........68........69.........70.....16............
+4f-3...+4f-2....+4f-1....+4f0......+4f1.....+4f2.....+4f3....16-5d
.........71........72.........73........74.......75...............................20............
-5d-2....-5d-1....-5d0.....-5d1....-5d2.............................+5d
........76........77.........78........79........80..............................21...........
+5d-2...+5d-1....+5d0....+5d1....+5d2.............................-6p
.........81........82.........83....................................................24............
-6p-1....-6p0.....-6p1..................................................+6p
........84.........85........86.....................................................26............
+6p-1...+6p0.....+6p1...................................................7s
...........87.........88................................................................30............
-7s0............................................................................................
+7s0...............................................................-5f
..........89.......90.........91.........92........93.........94........95......22...........
-5f-3.....-5f-2.....-5f-1.....-5f0.....-5f1......-5f2.....-5f3....+5f
.........96........97.........98........99........100.......101......102.....23............
+5f-3....+5f-2....+5f-1....+5f0....+5f1......+5f2....+5f3....-6d
.........103......104......105.......106.......107.............................27............
-6d-2....-6d-1....-6d0....-6d1......-6d2.............................+6d
.......108......109.......110.......111.......112.............................28...........
+6d-2...+6d-1....+6d0....+6d1.....+6d2............................-7p
........113.......114.......115...................................................29............
-7p-1....-7p0.....-7p1...................................................+7p
.......116......117.......118.....................................................31...........
+7p-1...+7p0.....+7p1....................................................8s
..........119......120.................................................................32............
-8s0..........................................................................................
+8s0...............................................................-------------------------------------------------------------------------
Conclusion d'étape : une sorte de correspondance hydrogène - atomes existe, mais il nous faut trouver une raison pour expliquer la différence de mise en ordre des lignes. Nous allons chercher cette raison par une méthode intuitive associée à la manipulation de blocs représentant les états et les éléments.
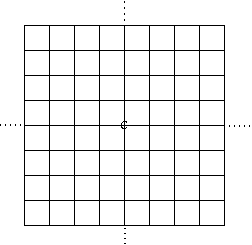
FIG. 2. Grille justifiée au centre C.
Chapitre 3
Manipulation des blocs
Les blocs et les grilles
Grilles. Le matériel fourni (prêt à l'emploi ou sous forme de nécessaire à compléter) comprend des blocs et des carrelages "historiés". Un carrelage forme une grille déterminant des cases carrées. FIGURE 2.
L'appellation mathématique correcte de nos carrelages et de nos grilles serait tableau, mais nous évitons ce terme qui prête à confusion avec les tableaux de présentation typographique.
Une des grilles fournies est organisée selon le tableau traditionnel de Mendeleev.
Certaines de nos grilles sont justifiées à une origine, rencontre d'une ligne verticale et d'une ligne horizontale marquée C pour centre. On peut y reconnaître des coordonnées x et y identifiant le centre de chaque case. On a choisi des cases beaucoup plus grandes que les blocs afin que ces derniers soient visibles latéralement.
Hydrogène. 32 blocs pour les états de l'hydrogène atomique, correspondant aux états successifs du TABLEAU 2.
Atomes. 120 blocs pour les états atomiques ou les atomes. Nous faisons usage en premier lieu des formules nominales des atomes. TABLEAU 3. Il y a un bloc pour chaque valeur de z.
Premières manipulations
1. On aligne les 32 blocs de l'hydrogène régulièrement dans l'ordre de leurs numéros d'ordre et on apprend à lire les caractères électroniques qu'ils portent.
2. On aligne les 120 blocs des atomes dans l'ordre de leurs numéros atomiques z de 1 à 120 et on apprend à reconnaître les écritures qu'ils portent : z, signe pour s, n, l, m, symbole et nom de l'atome. Un numéro est celui de la colonne dans la classification de Mendeleev. Une face - face atome, met en évidence l'atome, nom et symbole, la face opposée - face électron, le caractère de l'électron de même z.
Il y a donc au moins deux manières principales de réaliser l'alignement : faces électrons en haut, faces atomes en haut.
Alignement faces atomes en haut : c'est la suite des éléments.
Couleurs. Les faces principales sont codées en couleurs principales RJVB selon la valeur de l valant 1, 2, 3 ou 4, code littéral s, p, d ou f.
Les quatre autres côtés des blocs sont colorés en couleurs secondaires vert bleu pour le spin -, orangé pêche pour le spin +.
Ce qui n'est pas codé en couleurs : z, n et m.
3. On arrête l'alignement faces électrons en haut au numéro 118. Le bloc 118 est alors retourné pour montrer sa face atome. Le résultat est qu'on peut lire la formule électronique complète de l'atome z = 118, québécium Qb.
4. On arrête l'alignement précédent faces électrons en haut à un numéro z, disons 23 pour vanadium. On obtient ainsi la formule électronique nominale de l'atome z = 23. En retournant le bloc z, on peut afficher le nom de cet atome.
5. On examine les couleurs dans l'alignement réguliers des 120 blocs. On remarque aisément les blocs rouges qui se présentent 2 par 2 et peuvent servir à définir des suites appelées "périodes" parmi les éléments. Deux périodes consécutives de même longueur constituent ce que nous appelons une "strate".
6. Colonnes. On place chaque bloc sur la case de même nom de la grille de Mendeleev traditionnelle. On trouve alors certains alignements verticaux appelés colonnes, numérotées de 1 à 18 d'après les recommandations de l'Union internationale de chimie pure et appliquée. On remarque que notre bloc z = 2 de l'hélium porte le numéro de colonne 2 mais doit être ici placé dans la colonne 18. Dans la grille en question, il n'y a pas de numéros de colonne pour les Lanthanides et les Actinides. Nos blocs portent néanmoins des numéros de colonnes que nous leur avons attribués, de 19 à 32.
7. Sur l'une des grilles, on aligne en ordre vertical les 32 blocs de l'hydrogène. En regard de chacun de ces blocs, on aligne les 120 blocs des atomes, face électron en haut selon le TABLEAU 2. Il y 32 lignes horizontales. Les lignes des états s sont doublées, ce qui fait appasaître 40 lignes électroniques. Les numéros z ne sont pas tous consécutifs d'une ligne à la suivante.
8. On réarrange les lignes horizontales et on rend les valeurs de z consécutives selon le TABLEAU 3. Les 32 blocs de l'hydrogène ne sont pas dans l'ordre.
Chapitre 4
Construction du tableau
des éléments dans notre systèmePremière procédure
Nous utilisons l'ordre des blocs dans le TABLEAU 3.
Strate 1. Nous plaçons le bloc H1 comme indiqué dans la figure 3.
L'occupation de la case choisie définit un carré de 4 cases que nous appelons la strate 1. Nous choisissons de placer le bloc 2 en opposition par rapport au bloc 1 par rapport au centre. Nous continuons de remplir l'espace de la strate par les blocs 3 et 4 selon la figure. Nous obtenons des relations de symétrie OE et NS, NO et SE, SO et NE, spins - à l'ouest, spins + à l'est.
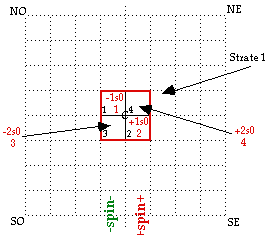
FIG. 3. Le bloc 1 vient dans la case 1 dans le quadrant NO. La strate 1 est définie par l'installation de -1s0 et +1s0 et ne peut être complétée que par -2s0 et +2s0. Petits chiffres : numérotage des cases dans la strate 1.
Sans perdre ces relations, nous déplaçons le contenu des cases O de deux cases vers l'ouest et celui des cases E de deux cases vers l'est. FIGURE 4.
Les symétries signalées sont conservées. Elles peuvent s'exprimer en algèbre : les cases répondent à la formule générale (±x, ±y) avec les 4 permutations de signe. Les permutations de signe affectant x changent le signe du spin.
Le déplacement proposé a pour but de libérer un carré centré à l'intention de la strate 2.
Périodes : période 1, blocs 1 et 2; période 2, blocs 3 et 4.
Les partenaires d'une orbitale se trouvent dans des cases en opposition par rapport au centre, l'un de spin - dans le demiant O, l'autre avec le spin + dans le demiant E.

FIG. 4. La strate 1 après déplacement symétrique, moitié O-, moitié E+. L'espace central est dégagé pour recevoir la strate 2, l'occupation des cases se faisant selon les petits numéros.
Strate 2. Les blocs 5, 6, 7 de spin - se placent dans l'équerre NO aux numéros de cases 1, 2, 3 de la figure 4. Ils appellent par symétrie le placement des blocs 8, 9, 10 aux cases SE en regard, de spin +, numérotées 4, 5, 6.
Puis il nous faut remplir les cases 7 et 8 par les blocs 11 et 12.
La période 3 est complétée.
La période 4 est ensuite réalisée par des opérations analogues. Cette période et la strate 2 se terminent sur le bloc 20. FIGURE 5.
Les symétries peuvent s'exprimer en algèbre : chacune des 16 cases répond à l'expression (±x, ±y), avec 4 valeurs du doublet x, y, correspondant à un doublet lm. Le double signe ± correspond à un échange portant sur chacun des nombres quantiques n et s.
Par exemple, le doublet p1 se présente avec les variantes n = 2 ou 3, spin - ou +.
Périodes : période 3, blocs 5 à 12, période 4, blocs 13 à 20.
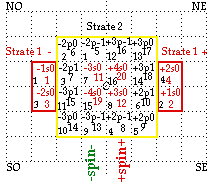
FIG. 5. Construction de la strate 2.
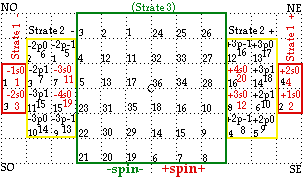
FIG. 6. Préparatifs pour loger la strate 3.
Sans perdre ces relations de symétrie, nous déplaçons le contenu des cases O de trois cases vers l'ouest et celui des cases E de trois cases vers l'est. L'espace central de 36 cases est prêt pour recevoir la strate 3. FIGURE 6.
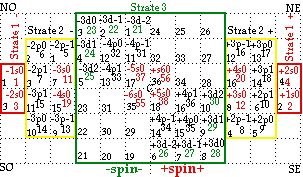
FIG. 7. Remplissage de la strate 3. Il est figuré incomplètement.
Strate 3. Les cases numérotées 1 à 10 reçoivent en deux équerres opposées les blocs 21 à 31, les cases numérotées 11 à16, les blocs 32 à 36, les cases numérotées 17 et 18, les blocs 37 et 38, Ainsi se termine la période 5, sur le bloc +5s0.
Par un jeu comparable, les cases des quadrants SO et NE se remplissent des blocs 39 à 56. Aini se terminent, sur le bloc +6s0, la période 6 et la strate 3. FIGURE 7.
Périodes : période 5, blocs 21 à 38, période 6, blocs 39 à 56.
Encore une fois, nous dégageons un espace central large cette fois de 8 cases, pour loger la strate 4, sans perdre pour autant les symétries quadruples des cases des strates 1, 2 et 3. FIGURE 8.
Strate 4. Les 36 cases centrales numérotées 15 à 32 et 47 à 64 reçoivent les blocs 71 à 88 et 103 à 120 respectivement, créant une répartitition en tout point comparable à celle de la strate 3 pour ce qui concerne les valeurs du signe du spin, celles de l et de m.
La différence réside dans les valeurs de n, qui sont de deux unités supérieures dans les cases qui se correspondent quand on passe de la strate 3 à la strate 4.
NB. Les éléments 111 à 120 sont spéculatifs. Leur présence sert à compléter des symétries. Des électrons +6d1, +6d2, -7p-1, -7p0, -7p1, +7p-1, +7p0, +7p1 et 8s0 s'observent expérimentalement, mais pas dans les atomes au repos.

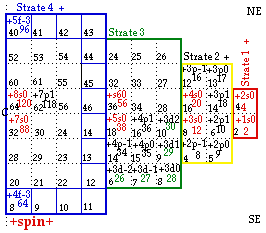
FIG. 8. Remplissage de la strate 4. Il est figuré incomplètement.
Quant aux 28 cases périphériques numérotées de 1 à 14 et de 33 à 60, elles reçoivent les blocs f, 7 blocs dans chaque quadrant.
La strate est ainsi le modèle de toutes les autres. Quant aux cases occupées, elle donne naissance aux autres par réduction d'une couronne périphérique à chaque étape. Quant aux blocs qui occupent les cases correspondantes, ils ont la même description sauf que n diminue de deux unités à chaque étape.
Autre procédure
Nous pouvons partir du TABLEAU 2 plutôt que du TABLEAU 3 et suivre la logique géométrique que voici.
Lignes 1 et 3. En plaçant le bloc 1s de la ligne 1, nous disons que nous amorçons une strate de 4 cases, qui réclame d'aller à la ligne 3 pour remplir les cases 3 et 4. La ligne 2 ne peut pas contribuer, parce que ses 3 blocs sont indissociables et ne trouvent pas place dans 2 cases.
Lignes 2, 4, 6, 5, 10 et 11. En continuant, nous amorçons une nouvelle strate, la strate 2 de 16 cases avec les 3 blocs -2p de la ligne 2 disposés en équerre. La suite du remplissage exige de recourir successivement aux lignes 4, 6, 5, 8 , 10 et 11.
Lignes 7, 9, 10, 13, 18, 12, 15, 17, 19, 25. Nous rencontrons ensuite la ligne 7 avec ses 5 blocs -3d à placer en équerre, ce qui amorce une strate 3 de 36 cases. La suite du remplissage exige de recourir successivement aux lignes 9, 10, 13, 18, 12, 15, 17, 19, 25.
Lignes 14, 16, 20, 21, 24, 26, 30, 22, 23, 27, 28, 29, 31, 32. Nous rencontrons enfin la ligne 14 avec ses 7 blocs 4f placés en équerre, qui amorcent la strate 4 de 64 cases. La suite du remplissage exige de recourir successivement aux lignes 16, 20, 21, 24, 26, 30, 22, 23, 27, 28, 29, 31, 32.
Cette logique nous a conduits à remanier l'ordre des lignes H de l'hydrogène de façon à donner précisément l'ordre du TABLEAU 3, qu'elle justifie.
Chapitre 5
Analyse de nos constructions
Compact
Placer les cases le plus près possible du centre.
Équerre
Les blocs d'une ligne électronique sont indissociables. Chacune de ces lignes forme une équerre symétrique, occupant 1, 3, 5 ou 7 cases, avec des bras de 0, 1, 2 ou 3 cases. Le nombre des cases dans ces bras est égal à l, quantum azimutal.
Une équerre est orientée vers une diagonale des points cardinaux.
Rotation
L'occupation des cases d'une équerre se fait dans le sens des aiguilles d'une montre dans les quadrants NE et SO, et dans le sens opposé dans les quadrants NO et SE. Les sens sont opposés par souci de symétrie
Période
Une période se termine sur un bloc +ns0, n = 1 à 8. Les périodes sont égales angulairement : chaque période occupe deux quadrants opposés d'ouverture 90o. Ces quadrants sont orientés NO SE pour les périodes impaires et SO NE pour les périodes paires.
Strate
Deux périodes successives de même longueur composent une strate. Les numéros des périodes sont : 1 et 2, 3 et 4, 5 et 6, 7 et 8.
Amorçage
Dès qu'une équerre apparaît lorsqu'on parcourt les lignes H, elle commande la formation d'une strate. Quatre lignes H sont ainsi des lignes d'amorçage : 1s ligne 1, -2p ligne 2, -3d ligne7, -4f ligne 14. L'équerre d'amorçage occupe un quadrant NO.
Une strate doit être complétée avant qu'une autre ne commence.
Couronne
À l'intérieur d'une strate, 4 équerres ayant même valeur de l déterminent une couronne. Pour l = 0, l'espace enfermé par la couronne est nul.
Symétries
La classification obtenue se recommande par ses synétries quadruples, qui remontent nécessairement à des symétries dans les forces intraatomiques. Puisqu'elles affectent même des états s pour lesquels l = 0, il est naturel de supposer qu'elles sont liées aux spins. Il faudrait examiner la théorie des octupôles, formés de 4 dipôles symétriquement placés aux 4 sommets d'un tétraèdre.
Dans toutes les cases d'une période, la somme n+l est constnnte et donne le numéro d'ordre de la période : 1 à 8.
Inscription dans une ellipse
La strate 1 s'inscrit dans un cercle de diamètre Ã2 ou dans une infinité d'ellipses dont le petit axe reste compris entre 1 et Ã2. L'unité est le côté d'une case de la grille.
La FIGURE 5 contenant les strates 1 et 2 s'inscrit exactement dans une ellipse. Les figures renfermant les strates 1, 2 et 3 ou les strates 1, 2, 3 et 4 s'inscrivent sensiblement dans une ellipse.
Le tableau elliptique des éléments est d'une simplicité remarquable et fait presque regretter la complication des classifications traditionnelles.
Chimie
À discuter : le cas de l'hélium.
La position moins évidente des gaz rares, que l'ancienne classification privilégiait.
Les éléments ne se suivent pas en de longues lignes droites.
Il faudra réécrire les manuels de chimie.
Chapitre 6
Autres manipulations
Superpositions
D'autres manipulations sont encore possibles par des superpositions de blocs. On peut créer des pyramides 3D à base carrée en rapprochant les moitiés O et E des strates 1, puis 2, puis 3. On peut se servir d'étagères ou de plaques transparentes pour supporter les superpositions, qui concrétisent les colonnes de Mendeleev, ici doubles : une pour les périodes impaires et une autre pour les périodes paires.
Dans ces pyramides, les symétries par rapport au centre C sont remplacées par des symétries par rapport à un axe vertical C.
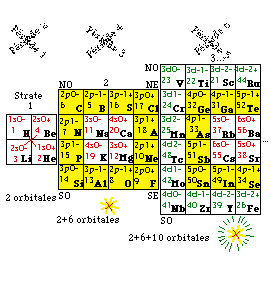
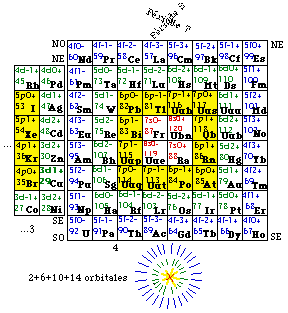
FIG. 9 . Cette classification tient dans une demi-ellipse ouverte à l'est (non figurée). On a mis en évidence les orbitales.
Classification en demi-ellipse
Il est possible de réunir côte-à-côte les moitiés O et E des strates 1, 2 et 3 et de les joindre à l'ouest de la strate 4. L'ensemble se loge dans une demi-ellipse. FIGURE 9.
Dans cette figure, il n'y a pas de centre de symétrie unique. Il y en a un distinct dans chaque strate. Les demiants de spin - et + alternent.
Codage de m. Les codages colorés identifient s et l. On peut ajouter un codage en hauteur des blocs : l'addition de blocs neutres, qui marque à vue d'oeil la progression de m dans une équerre, culminant au voisinage de la ligne ouest - est. Le relief obtenu aide grandement la lecture de la classification et facilite d'apercevor les étages inférieurs lorsqu'on recourt à des superpositions. (FIGURE 11).
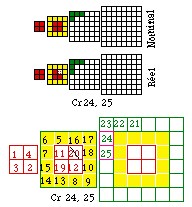
FIG. 10. Un atome exceptionnel. Cr24 renferme 24 électrons, l'électron 20 fait défaut, il renferme jusqu'à l'électron 25 : Cr 24, 25 (non 20).
Les exceptions
Il est facile de démontrer la formule électronique complète des atomes exceptionnels tel que Cr24, en plaçant correctement les blocs représentatifs des électrons de la formule et en retournant les autres face latérale en l'air. FIGURE 10.
Une manière de signaler le caractère exceptionnel d'un atome consiste à faire suivre son symbole de deux nombres, l'un égal à z nombre d'électrons qu'il renferme et l'autre égal au numéro d'électron le plus élevé qu'il renferme. Ainsi Cr24, 25. Sa formule complète serait Cr24, 25 (non 20).
Il se distingue néanmoins de Mn25 qui renferme l'électron 20.

FIG. 11. Classification en relief. Dans chaque équerre, la hauteur du relief marque la progression de m, de la plus négative à la plus positive. On montre ici la formule du québécium. Le bloc 118 est seul tourné face symbole en l'air. Les blocs 1 à 117 sont tournés la face électronique en l'air. Les blocs 119 et 120 ne servent pas et sont tournés une face latérale en l'air. - Les blocs spin - et spin + forment deux groupes aisément reconnus par leurs couleurs latérales. - La grille est celle de la FIGURE 13 : 16EllStr1234.gif
FIG. 12. À venir. Classification 3D, pyramides.
Conclusion.
On ne peut pas innover sans changer les habitudes.
La vérité et le progrès des connaissances ont des droits que l'erreur et la routine ne possèdent pas.
L'auteur souhaite collaborer avec des pédagogues afin de mettre au point ce qui est ici proposé.
QbSyst2e.23quaterhtml
Système du Québécium Suivant QbSyst2e.23quinte.html
Précédent QbSyst2e.23bis.html